9.PRINCIPIOS DE CORROSIÓN
9.1 TIPOS DE CORROSIÓN
9.1.2 Corrosión de localizada.
9.1.3 Corrosión electro-química.
9.2 PROTECCIÓN CONTRA LA CORROSIÓN
9.2.1 Algunos Metodos para Evitar la Corrosion.
9.3 PROCESOS INDUSTRIALES DE RECUBRIMIENTO.
9.3.2 Niquelado electrolítico.
9.3.3 Recubrimiento metálico de cromo.
9.3.5 Galvanizado en caliente.
9.3.6 Galvanizado electro-químico.
9.3.7 Galvanizado por inmersión.
9.4 VELOCIDAD DE CORROSIÓN
9.5 VELOCIDADES DE OXIDACIÓN (CINÉTICA).
9.6 LA CORROSIÓN EN LA ECONOMÍA.
9.7 EJERCICIOS, IMAGENES Y VIDEOS
9. PRINCIPIOS DE CORROSIÓN.
DEFINICIÓN
La corrosión es definida como el deterioro de un material metálico a consecuencia de un ataque químico por su entorno. Siempre que la corrosión esté originada por una reacción química, la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, la salinidad del fluido y las propiedades de los metales en cuestión [1].En la Figura 1 podemos observar un claro ejemplo de una corrosión severa debida a medios severos como lo es el agua de mar.
Figura 1. Corrosión debida a medios severos [2].
- oxidación es cuando en una reacción química se pierden electrones.
- reducción es cuando se ganan electrones.
CONTROL DE LA CORROSIÓN.
La corrosión puede controlarse o prevenirse mediante diferentes métodos. Desde el punto de vista industrial, la economía de la situación suele determinar el método utilizado. Por ejemplo, un ingeniero quizá tenga que determinar si es más económico sustituir periódicamente cierto equipo o fabricarlo con materiales que son sumamente resistentes a la corrosión pero más caros para que sean más durables. Algunos de los métodos de control de corrosión comunes se muestran en la Figura 2.
Figura 2. Métodos comunes de control de la corrosión.[35]
9.1 TIPOS DE CORROSIÓN
Es aquella corrosión que se produce con el adelgazamiento uniforme producto de la pérdida regular del metal superficial. Esto ocurre por la atmósfera quien es la que produce mayor cantidad de daños en el material por lo que se ven atacados por oxigeno y al agua, La severidad de esta clase de corrosión se incrementa cuando la sal, los compuestos de sulfuro y otros contaminantes atmosféricos están presentes,en la Figura 19 se puede observar claramente este tipo de corrosion . Los ambientes atmosféricos son los siguientes:
Industriales: Son los que contienen compuestos sulfurosos, nitrosos y otros agentes ácidos que pueden promover la corrosión de los metales. En adición, los ambientes industriales contienen una gran cantidad de partículas aerotransportadas, lo que produce un aumento en la corrosión.
Urbana: es un ambiente muy similar al industrial ya que generalmente se encuentra cerca de dichas zonas en grandes urbes, por lo que se ve afectado en gran medida por la lluvia ácida que se genera en las zonas industriales y es transportada por lo vientos de la región. Otro importante contaminante de este ambiente es el dióxido de carbono (CO2) producido por el gran flujo vehícular que existe en estas zonas
Marinos: Esta clase de ambientes se caracterizan por la presencia de sales (NaCl) e iones cloruro (un ión particularmente perjudicial que favorece la corrosión de muchos sistemas metálicos.), en las cercanías al mar. El primero es un contaminante natural y llega a la atmósfera por medio de los vientos provenientes del interior del mar.
La intensidad debido a los grados de salinidad en la atmósfera depende de la distancia al borde del mar ya que la concentración de sales y la velocidad de corrosión disminuye notoriamente luego de unos cuantos metros de la costa.
Rurales: En estos ambientes se produce la menor clase de corrosión atmosférica, caracterizada por bajos niveles de compuestos ácidos y otras especies agresivas. Existen factores que influencian la corrosión atmosférica. Ellos son la Temperatura, la Presencia de Contaminantes en el Ambiente y la Humedad [3].
9.1.2 Corrosión localizada
La segunda forma de corrosión, en donde la pérdida de metal ocurre en áreas discretas o localizadas, esta se divide
9.1.2.1 Corrosión Galvánica.
La corrosión galvánica (Figura 19) se presenta, cuando dos metales diferentes en contacto o conectados por medio de un conductor eléctrico, son expuestos a una solución conductora. En este caso, existe una diferencia en potencial eléctrico entre los metales diferentes y sirve como fuerza directriz para el paso de la corriente eléctrica a través del agente corrosivo, de tal forma que el flujo de corriente corroe uno de los metales del par formado.
Mientras más grande es la diferencia de potencial entre los metales, mayor es la probabilidad de que se presente la corrosión galvánica debiéndose notar que este tipo de corrosión sólo causa deterioro en uno de los metales, mientras que el otro metal del par casi no sufre daño.
El metal que se corroe recibe el nombre de metal activo, mientras que el que no sufre daño se le denomina metal más noble.
La relación de áreas entre los dos metales es muy importante, ya que un área muy grande de metal noble comparada con el metal activo, acelerará la corrosión, y por el contrario, una mayor área del metal activo comparada con el metal noble disminuye el ataque del primero.
La corrosión galvánica a menudo puede ser reconocida por el incremento del ataque junto a la unión de los metales, este tipo puede ser controlado por el uso de aislamientos o restringiendo el uso de uniones de metales cuando ellos forman diferencias de potencial muy grande en el medio ambiente en el que se encuentran. La diferencia de potencial puede ser medida, utilizando como referencia la serie galvánica de los metales y aleaciones que se presentan más adelante, en la serie de los potenciales tipo (standard) de óxido de reducción.
Otro método para reducir la corrosión galvánica, es evitar la presencia de grandes áreas de metal noble con respecto a las de metal activo, acelerará la corrosión, y por el contrario, una mayor área del metal activo comparada con el metal noble disminuye el ataque del primero [4].
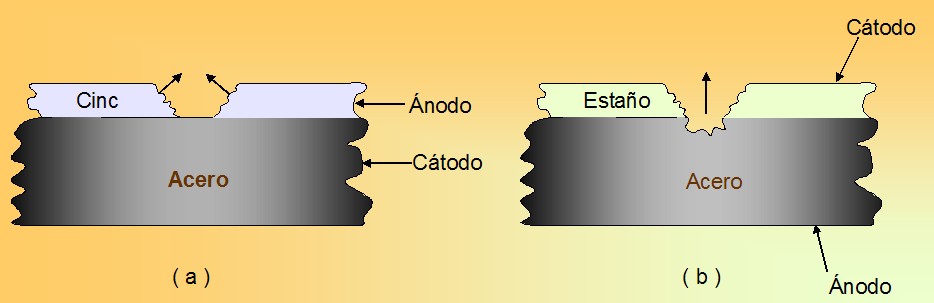
Figura 19.comportamiento anódico-catódico del acero con capas de zinc y estaño expuestas a la atmosfera.a)se corroe el cinc.b)se corroe el acero
9.1.2.2 Corrosión por erosión.
Es cuando el movimiento del medio corrosivo sobre la superficie metálica incrementa la velocidad de ataque debido a desgaste mecánico, este recibe el nombre de corrosión por erosión. La erosión generalmente se atribuye a la remoción de películas superficiales protectoras, como por ejemplo, películas de óxido formadas por el aire, o bien, productos adherentes de la corrosión. La corrosión por erosión, generalmente tiene la apariencia de picaduras poco profundas de fondo.
La corrosión por erosión prospera en condiciones de alta velocidad, turbulencia, choque, etc., y frecuentemente se observa en impulsores de bombas, agitadores y en codos y cambios de dirección de tuberías. Los líquidos con suspensión conteniendo partículas sólidas duras pueden igualmente causar este tipo de problema [5].la Figura 3 muestra el inicio de una corrosión por cavitación.
Figura 3. Corrosión por cavitación en el esquema del mecanismo de turbulento remolino de aguas [6]
9.1.2.3 Corrosión Por Agrietamiento.
Definimos como agrietamiento por corrosión (Figura 20), al proceso físico-químico a través del cual los metales, cuando están sometidos a esfuerzos mecánicos, simultaneados con una exposición a ambientes corrosivos, presentan una fatiga estructural que desemboca en la aparición de fisuras y grietas con resultado de una disminución de su resistencia intrínseca. No se suelen observar grandes extensiones afectadas, lo cual resulta bastante engañoso, y consecuentemente peligroso, debido a que las grietas formadas, aparentemente superficiales, tienen la particularidad de ser de contextura fina pero profunda, lo cual redunda en un elevado riesgo de rotura [7].
Figura 20. Ejemplos corrosión por agrietamiento.
9.1.2.4 Corrosión por Picadura o “Pitting”.
Es altamente localizada, se produce en zonas de baja corrosión generalizada y el proceso (reacción) anódico produce unas pequeñas “picaduras” en el cuerpo que afectan (figura 21) .Puede observarse generalmente en superficies con poca o casi nula corrosión generalizada. Ocurre como un proceso de disolución anódica local donde la pérdida de metal es acelerada por la presencia de un ánodo pequeño y un cátodo mucho mayor.
Esta clase de corrosión posee algunas otras formas derivadas:
- Corrosión por Fricción o Fretting: es la que se produce por el movimiento relativamente pequeño (como una vibración) de 2 sustancias en contacto, de las que una o ambas son metales. Este movimiento genera una serie de picaduras en la superficie del metal, las que son ocultadas por los productos de la corrosión y sólo son visibles cuando ésta es removida.
- Corrosión por Cavitación: es la producida por la formación y colapso de burbujas en la superficie del metal (en contacto con un líquido). Es un fenómeno semejante al que le ocurre a las caras posteriores de las hélices de los barcos. Genera una serie de picaduras en forma de panal.
- Corrosión Selectiva: es semejante a la llamada Corrosión por Descincado, en donde piezas de cinc se corroen y dejan una capa similar a la aleación primitiva. En este caso, es selectiva porque actúa sólo sobre metales nobles como al Plata-Cobre o Cobre-Oro. Quizá la parte más nociva de esta clase de ataques está en que la corrosión del metal involucrado genera una capa que recubre las picaduras y hace parecer al metal corroído como si no lo estuviera, por lo que es muy fácil que se produzcan daños en el metal al someterlo a una fuerza mecánica
figura 21. corrosión pon pitting (6)
9.1.2.5 Corrosión Por Fricción.
Es la que se produce por el movimiento relativamente pequeño (como una vibración) de 2 sustancias en contacto (figura 22), de las que una o ambas son metales. Este movimiento genera una serie de picaduras en la superficie del metal, las que son ocultadas por los productos de la corrosión y sólo son visibles cuando ésta es removida [9].
figura 22. Corrosión por fricción [6]
9.1.2.6 Corrosión selectiva.
Es semejante a la llamada Corrosión por Descincado (figura 23), en donde piezas de Zinc se corroen y dejan una capa similar a la aleación primitiva. En este caso, es selectiva porque actúa sólo sobre metales nobles como al Plata-Cobre o Cobre-Oro. Quizá la parte más nociva de esta clase de ataques está en que la corrosión del metal involucrado genera una capa que recubre las picaduras y hace parecer al metal corroído como si no lo estuviera, por lo que es muy fácil que se produzcan daños en el metal al someterlo a una fuerza mecánica.
figura 23 corrosión selectiva. [6]
9.1.2.7 Corrosión intercristalina.
Se define como corrosión intercristalina (Figura 24), o corrosión intergranular al grado de desintegración electroquímica que se produce en los límites de grano de un metal, como consecuencia de la pérdida de características debidas al calentamiento generado, por ejemplo, en las zonas de transición de las soldaduras.
 Figura 24. Corrosión intercristalina. [6]
Figura 24. Corrosión intercristalina. [6]
9.1.2.8 Corrosión Microbiológica (MIC).
Es aquella corrosión en la cual organismos biológicos son la causa única de la falla o actúan como aceleradores del proceso corrosivo localizado.
La MIC se produce generalmente en medios acuosos en donde los metales están sumergidos o flotantes. Por lo mismo, es una clase común de corrosión,Su accionar está asociado al pitting (picado) del oxígeno o la presencia de ácido sulfhídrico en el medio( En este caso Figura 25 se clasifican las ferrobacterias).Los organismos biológicos presentes en el agua actúan en la superficie del metal, acelerando el transporte del oxígeno a la superficie del metal, acelerando o produciendo, en su defecto, el proceso de la corrosión [8]
Figura 25. Corrosión microbiológica causada por ferrobacterias. [8]
9.1.2.9 Corrosión bajo tensión.
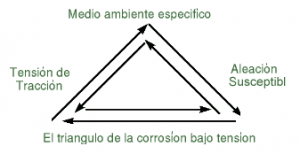
La corrosión bajo tensión (CBT) es un mecanismo de rotura progresivo de los metales que se crea por la combinación de un medio ambiente corrosivo y de una tensión de tracción mantenida. El fallo estructural debido a la CBT es muchas veces, imprevisible y aparece tanto tras pocas horas como tras meses o años de servicios satisfactorios. Se encuentra, frecuentemente, en ausencia de cualquier otro tipo de ataque corrosivo. Virtualmente, todas las aleaciones son sensibles a la CBT en un medio ambiente específico y con un conjunto de condiciones .La Figura 4 presenta el triángulo de la corrosión bajo tensión, en el cual cada lado debe estar presente para que la CBT aparezca.
Figura 4. Triángulo de la corrosión bajo tensión [13].
La tensión de tracción necesaria para la CBT está «estática», y puede ser residual y/o aplicada (véase la tabla debajo). El agrietamiento progresivo debido a tensiones «cíclicas» se llama la «fatiga-corrosión». El límite entre la CBT y la fatiga-corrosión no es evidente a cada vez. Sin embargo, como los mecanismos que provocan cada fenómeno son distintos, se separan y se consideran como mecanismos de rotura diferentes. El shot peening controlado, introduciendo una tensión residual de compresión en la superficie del material, actúa sobre los dos fenómenos y puede impedirlos o retrasarlos [13].
9.1.2.10 Corrosión por hidrógeno.
Son fenómenos destructivos que se relacionan de manera directa con la presencia de hidrógeno atómico o molecular, exceptuando la formación de hidruros, no producen oxidación metálica y no constituyen fenómenos típicos de corrosión aunque por su procedencia o efecto similar son tratados por los encargados de estudiar estos fenómenos de la corrosión.
Suelen suceder en gases a elevadas temperaturas o en electrólitos a bajas temperaturas, los que suceden en electrólitos se caracterizan por su predominio de los efectos físicos y físico-químicos sobre las acciones químicas y electro-químicas, por lo que se incluyen dentro de los tipos de corrosión con efectos mecánicos.
Los daños por hidrógeno más importantes son:
1. Descarburización.
2. Ataque por hidrógeno.
3. Ampollamiento por hidrógeno.
4. Fragilidad y ruptura por hidrógeno.
Los primeros dos corresponden al campo de la corrosión gaseosa de los metales y aleaciones a temperaturas elevadas,en la Figura 5 se puede observar un ejemplo de una microestructura con daño por hidrógeno [14].
Figura 5. Figuras intergranulares y descarburación [14].
9.1.3 Corrosión electroquímica (celda electroquímica)
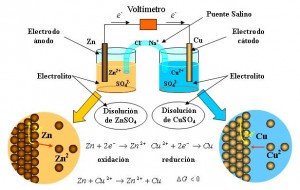
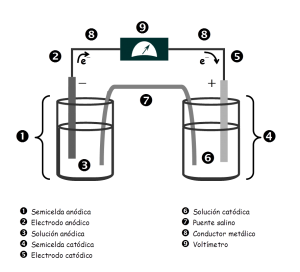
Celdas electro-químicas: Son aquellas en las cuales la energía eléctrica que procede de una fuente externa provee reacciones químicas no espontáneas [17].en la Figura 6 se puede observar una celda electroquimica de Zn-Cu con sus componentes.
Figura 6. Celda electroquímica [17].
Clasificación:
- Celda electrolítica: son aquellas en las cuales la energía eléctrica que procede de una fuente externa provoca reacciones químicas no espontáneas generando un proceso denominado electrólisis. Las celdas electrolíticas constan de un recipiente para el material de reacción, dos electrodos sumergidos dentro de dicho material y conectados a una fuente de corriente directa.
- Celdas galvánicas o voltaicas: son celdas electroquímicas en las cuales las reacciones espontáneas de óxido-reducción producen energía eléctrica. Las dos mitades de la reacción de óxido reducción, se encuentran separadas, por lo que la transferencia de electrones debe efectuarse a través de un circuito externo [16].
Constituyentes de la celda:
> Cátodo: se define como el electrodo en el cual se produce la reducción porque algunas especies ganan electrones. Este posee carga negativa y a él migran los iones o cargas positivas.
> Ánodo: se define como el electrodo en el cual se produce la oxidación porque algunas especies pierden electrones. Este posee carga positiva y a él migran los electrones o cargas negativas.
> Puente salino: Es un tubo con un Puente salino electrólito en un gel que está conectado a las dos semiceldas de una celda galvánica; el puente salino permite el flujo de iones, pero evita la mezcla de las disoluciones diferentes que podría permitir la reacción directa de los reactivos de la celda [17].
Son un dispositivo en el que la transferencia de electrones, (de la semireacción de oxidación a la semireacción de reducción), se produce a través de un circuito externo en vez de ocurrir directamente entre los reactivos; de esta manera el flujo de electrones (corriente eléctrica) puede ser utilizado.
En la Figura 7, se muestran los componentes fundamentales de una celda galvánica o voltaica:
Figura 7.Esquema pila galvánica o voltaica [18].
¿Cómo funciona una celda galvánica?
En la semicelda anódica ocurren las oxidaciones, mientras que en la semicelda catódica ocurren las reducciones. El electrodo anódico, conduce los electrones que son liberados en la reacción de oxidación, hacia los conductores metálicos. Estos conductores eléctricos conducen los electrones y los llevan hasta el electrodo catódico; los electrones entran así a la semicelda catódica produciéndose en ella la reducción .
En la Tabla 1 se muestra el potencial de reducción de electrones en volts de algunos elementos con respecto al hidrógeno [18].
Tabla 1. potencial electrodo estándar a 25°C “respecto al potencial del hidrógeno”[19].
Tipos de celdas galvánicas.
Principales tipos:
Celdas galvánicas primarias.
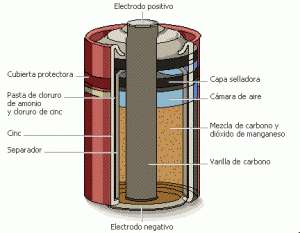
Las celdas galvánicas primarias pueden producir corriente inmediatamente después de su conexión. Las pilas desechables están destinadas a ser utilizadas una sola vez y son desechadas posteriormente. Las pilas desechables no pueden ser recargadas de forma fiable, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos no pueden volver a su forma original.
Generalmente, tienen densidades de energía más altas que las pilas recargables, pero las células desechables no van bien en aplicaciones de alto drenaje con cargas menores de 75 ohmios (75 Ω) [18].
Figura 8. Imagen pila seca en la cual se produce una fem de 1.5V [19].
Celdas galvánicas secundarias.
Las celdas galvánicas secundarias deben ser cargadas antes de su uso; por lo general son ensambladas con materiales y objetos activos en el estado de baja energía (descarga). Las celdas galvánicas recargables o pilas galvánicas secundarias se pueden regenerar (coloquialmente, recargar) mediante la aplicación de una corriente eléctrica, que invierte la reacciones químicas que se producen durante su uso. Los dispositivos para el suministro adecuado de tales corrientes que regeneran las sustancias activas que contienen la pila o batería se llaman, de modo inapropiado, cargadores o recargadores. La forma más antigua de pila recargable es la batería de plomo-ácido. Esta celda electroquímica es notable, ya que contiene un líquido ácido en un recipiente sellado, lo cual requiere que la celda se mantenga en posición vertical y la zona de estar bien ventilada para garantizar la seguridad de la dispersión del gas hidrógeno producido por estas células durante la sobrecarga. La celda de plomo-ácido es también muy pesada para la cantidad de energía eléctrica que puede suministrar. A pesar de ello, su bajo costo de fabricación y sus niveles de corriente de gran aumento hacen que su utilización sea común cuando se requiere una gran capacidad (más de 10A h) o cuando no importan el peso y la escasa facilidad de manejo.
Un tipo mejorado de la celda de electrolito líquido es la celda de plomo-ácido regulada por válvula de sellado (VRLA,por sus siglas en inglés), popular en la industria del automóvil como un sustituto para la celda húmeda de plomo-ácido, porque no necesita mantenimiento. La celda VRLA utiliza ácido sulfúrico inmovilizado como electrolito, reduciendo la posibilidad de fugas y ampliando la vida útil. Se ha conseguido inmovilizar el electrolito, generalmente por alguna de estas dos formas:
§ Celdas de gel que contienen un electrolito semi-sólido para evitar derrames.
§ Celdas de fieltro de fibra de vidrio absorbente, que absorben el electrolito en un material absorbente realizado con fibra de vidrio especial.
Otras células portátiles recargables son (en orden de densidad de potencia y, por tanto, de coste cada vez mayores): celda de níquel-cadmio (Ni-Cd), celda de níquel metal hidruro (NiMH) y celda de iones de litio (Li-ion). Por el momento, las celdas de ion litio tienen la mayor cuota de mercado entre las pilas secas recargables. Mientras tanto, las pilas de NiMH han sustituido a las de Ni-Cd en la mayoría de las aplicaciones debido a su mayor capacidad, pero las de NiCd siguen usándose en herramientas eléctricas, radios de dos vías, y equipos médicos [18].
9.2 PROTECCIÓN CONTRA LA CORROSIÓN
9.2.1 Algunos métodos para evitar la corrosión.
La corrosión puede ser controlada o prevenida por métodos muy diferentes. Desde un punto de vista industrial, los aspectos económicos de la situación son normalmente los decisivos respecto al método a elegir. Por ejemplo, un ingeniero debe determinar si es más económico reemplazar periódicamente determinado equipamiento o fabricarlo con materiales que sean altamente resistentes a la corrosión pero más caros, de tal forma que duren más(en la Figura 9 se puede ver el claro deterioro de los materiales sin protección contra la corrosión).Algunos de los métodos más comunes de control o prevención de la corrosión se muestran a continuación:
Recubrimientos: Estos son usados para aislar las regiones anódicas y catódicas e impiden la difusión del oxígeno o del vapor de agua, los cuales son una gran fuente que inicia la corrosión o la oxidación.[2]
Elección del material: La primera idea es escoger todo un material que no se corroa en el ambiente considerado. Se pueden utilizar aceros inoxidables, aluminios, cerámicas, polímeros (plásticos), FRP, etc. La elección también debe tomar en cuenta las restricciones de la aplicación (masa de la pieza, resistencia a la deformación, al calor, capacidad de conducir la electricidad, etc.).[2]
Cabe recordar que no existen materiales absolutamente inoxidables; hasta el aluminio se puede corroer. En la concepción, hay que evitar las zonas de confinamiento, los contactos entre materiales diferentes y las heterogeneidades en general. Hay que prever también la importancia de la corrosión y el tiempo en el que habrá que cambiar la pieza (mantenimiento preventivo).[2]
Diseño: El diseño de las estructuras del metal, estas pueden retrasar la velocidad de la corrosión.[2]
Protección de Barrera: Pinturas (Liquida o en polvo),Deposito electrolítico (cincado, cromado, estañado etc.)Y Metalizados.[2]
Recubrimientos protectores
Estos recubrimientos se utilizan para aislar el metal del medio agresivo. Veamos en primer lugar aquellos recubrimientos metálicos y no-metálicos que se pueden aplicar al metal por proteger, sin una modificación notable de la superficie metálica.[2]
Recubrimientos no-metálicos: Podemos incluir dentro de éstos las pinturas, barnices, lacas, resinas naturales o sintéticas. Grasas, ceras, aceites, empleados durante el almacenamiento o transporte de materiales metálicos ya manufacturados y que proporcionan una protección temporal.[2]
Recubrimientos orgánicos de materiales plásticos: Esmaltes vitrificados resistentes a la intemperie, al calor y a los ácidos.[2]
Recubrimientos metálicos: Pueden lograrse recubrimientos metálicos mediante la electrodeposición de metales como el níquel, cinc, cobre, cadmio, estaño, cromo, etcétera.[2]
Reducción química (sin paso de corriente): Por ese procedimiento se pueden lograr depósitos de níquel, cobre, paladio, etc. Recubrimientos formados por modificación química de la superficie del metal. Los llamados recubrimientos de conversión consisten en el tratamiento de la superficie del metal con la consiguiente modificación de la misma. Entre las modificaciones químicas de la superficie del metal podemos distinguir tres tipos principales:
- Recubrimientos de fosfato: El fosfatado se aplica principalmente al acero, pero también puede realizarse sobre cinc y cadmio. Consiste en tratar al acero en una solución diluida de fosfato de hierro, cinc o manganeso en ácido fosfórico diluido. Los recubrimientos de fosfato proporcionan una protección limitada, pero en cambio resultan ser una base excelente para la pintura posterior.
- Recubrimiento de cromato. Se pueden efectuar sobre el aluminio y sus aleaciones, magnesio y sus aleaciones, cadmio y cinc. Por lo general, confieren un alto grado de resistencia a la corrosión y son una buena preparación para la aplicación posterior de pintura.[2]

Figura 9. Materiales con y sin control de corrosión [37]
9.2.2 Tratamientos de Superficie
TRATAMIENTOS DE SUPERFICIE
Se impide la corrosión cubriendo al metal que se desea proteger con una película adherente de un metal que no se corroa.Las película puede ser construida con materiales variados: metálicos, inorgánicos u orgánicos.
A) Protección con coberturas metálicas
I) Fusión:
El material que se desea proteger se sumerge en un baño que contiene el metal protector en estado de fusión.
Así se preparan la hojalata y el hierro galvanizado.
a) Hojalata: Se llama así al hierro recubierto con un baño de estaño (el cual puede realizarse por fusión o recubrimiento electrolítico): La protección con estaño dura mientras la lámina no presente raspadur
Si ello llega a suceder, lo que es factible, por la delgadez de las chapas de hojalata, se produce el par Fe/Sn. Siendo el el más reductos de los dos metales, actúa como ánodo y proporciona la protección
catódica al estaño. Esto aumenta el proceso de corrosión del hierro que, a partir de la raspadura, se corroe rápidamente.[30]
b) Galvanizado: El hierro galvanizado es mucho más durader El galvanizado consiste en recubrir el hierro con un baño de cinc (el cual puede realizarse por fusión o recubrimiento electrolítico. El cinc es un metal que como el estaño se protege a si mismo, pues al reaccionar en el CO2 y el O2 de la atmósfera forma una capa adherente que evita la corrosión posterior.
Si pasa con el hierro galvanizado lo mismo que con la hojalata (perforaciones o raspaduras del cinc) y el cinc y el hierro quedan libres al aire, se forma el par Zn/Fe, pero siendo el potencial de reducción del cinc menor que el del hierro es el cinc el que experimenta el proceso de corrosión, con mayor intensidad, impidiendo la corrosión del hierro. Los compuestos que forma el cinc al oxidarse cubren la raspadura u orificio, protegiendo la exposición al aire, evitando que la corrosión continúe.
El cinc no puede usarse para envasar alimentos, pues con los ácidos de éstos forma compuestos tóxicos, cosa que no sucede con el estaño (hojalata).
- c) Cobertura con plomo: Los metales que se desean proteger de la corrosión suelen cubrirse con plomo.La cubierta con plomo puede darse por pulverización (schoop), por medios eléctricos (ver recubrimiento electrolítico) o por el llamado método homogéneo.Este procedimiento consiste en alear el plomo con el metal a cubrir, por medio de la fusión.Se limpia el metal por medio de un chorro de arena comprimido (decapado) para quitar impureza, grasa y óxidos y se vuelca sobre la superficie, el plomo fundido.Previamente, puede darse al metal a cubrir, un baño de estaño para lograr una adherencia más firme.Se busca evitar la formación de poros, pues por ellos puede penetrar el agente corrosivo. El método moderno de recubrimiento con plomo, se denomina Schlundt.Previa limpieza del acero a cubrir, por medio de lavado ácido y enjuague (“pickling”) y posterior decapage(lavado con chorro de arena) se aplica una capa de plomo con el auxilio del soplete oxhídrico.Luego se aplica otra capa de plomo por fusión, también con el soplete oxhídrico, de manera que la llama penetre hasta la primera capa.El espesor total de la cobertura de plomo llega a los 3 mm.La capa de plomo ya fijada se raspa con cuchillas manejadas a mano, quitando impurezas y porosidad.La capa de plomo queda reducida a 1,5 mm. Sobre esta capa de plomo se van superponiendo otras capas, repitiendo el raspado sobre cada una de ellas, se logra así , espesores no porosos de hasta 6 mm.Se puede lograr, para coberturas especiales, capas de hasta 12 mm.El plomo así endurecido da intensa protección a los metales contra la corrosión.Se emplea el metal así protegido para construir llaves y bombas par ácidos. Para estos casos, se puede alear el plomo con antimonio al 10%.El ácido sulfúrico forma sobre el plomo, una capa de sulfato adherente que protege al metal delposterior ataque.
La Tabla 2 que sigue, indica el ataque que experimenta el plomo por acción del ácido sulfúrico
| % H 2SO4 | Temperatura | Capa disuelta en mm |
| 2,5 | 25 ºC | 0,000165 |
| 5,0 | 40ºC | 0,000025 |
| 100,0 | 25ºC | 0,40 |
Tabla 2 plomo por acción del ácido sulfúrico [31]
II) Cementado:
Este procedimiento consiste en calentar al metal que se desea proteger, con otro metal (protector) en polvo, a una temperatura inferior al punto de fusión del metal menos fusible. Según el metal que se emplea para cubrir por cementación al hierro, el proceso toma nombres variados:
a) Cementado con cinc: Shedariz b) Cementado con cromo: Cromizado. c) Cementado con silicio: Siliconado.[30]
III) Recubrimiento electrolítico:
Por medio de este método se cubre al hierro con un baño de metal protector que se deposita por un proceso electrolítico. El objeto a cubrir, actúa como cátodo en una cuba electrolítica.La solución de la cuba es de una sal del metal que se emplea como protector. El ánodo está constituido por el metal protector.Para lograr un buen depósito se debe pulir bien la pieza a proteger.Su superficie debe estar libre de sustancias extrañas.
Es muy importante la densidad de la corriente(densidad = I/s); la concentración de la solución y la temperatura.
Los metales que se emplean como agentes protectores, son el cobre (para proteger a los metales que no van a estar en contacto con alimentos), el cinc (galvanizado), el estaño (hojalata), el cromo, el níquel, el oro y la plata.
- IV) Enchapado:
Se llama así al recubrimiento de metales no nobles con láminas de metales nobles.Así se preparan lingotes de hierro protegidos con láminas de cobre que puede, luego, laminarse o reducirse a alambres.Los dos metales que se emplean en el enchapado deben tener coeficientes de maleabilidad muy semejantes.[31]
- V) Aspersión catódica:
En una cámara de vacío, provista d un ánodo y un cátodo (este último, construido con el metal con el cual se desea recubrir a los objetos que se deben proteger de la herrumbre), se colocan las piezas metálicas.Se produce una descarga de 1000 a 2000 voltios. El cátodo se volatiliza, depositándose su vapor metálico sobre los objetos que se desean proteger.
- B) Protección por coberturas inorgánicas:
- I) Vidriado: Se prepara el esmalte vidriado fundiendo una mezcla de cuarzo (SiO2) y feldespato con fundente como la criolita (3NaF;AlF3) y el carbonato de sodi
El objeto a vidriar se sumerge, previa limpieza y desengrasamiento del mismo, en dicha mezcla o se aplica ésta a soplete.Se colocan, luego, las piezas así cubiertas en un horno que las deja esmaltadas.Se emplea el esmaltado para cubrir artefactos sanitarios, vagones tanques utilizados para transportar productos químicos o alimentos, etcétera.
- II) Fosfatizado: Por este método se logra la protección del Fe, Cd, Al, Mg, Cu y sus aleaciones, con una solución de Ácido fosfórico / sal del ácido fosfórico, en determinadas condiciones
Este método de protección se emplea para lograr:
- a) Mejor adherencia de pinturas o recubrimientos plásti
- b) Mejor lubricación para procesos de deformación en frío (estampado, laminado, embutido, estirado, etc.)
- c) Crear una capa antifricción.
Fue ensayado por primera vez, por una compañía llamada “Parker”. Por este motivo, al método se lo denomina “Parkerizado”.La protección que se logra no es total, pues la superficie metálica que se desea proteger, queda porosa. Se deposita sobre la superficie una fina capa de cristales de fosfatos metálicos fuertemente adheridos al metal base y de muy baja conductividad eléctrica.Los fofatizantes a base de sales de Zn tienden a producir depósitos de cristales pequeños a medianos y se los emplea para los casos a) y b); los basados en sales de Mn, que producen cristales grandes, se utilizan para c).
En el curso del proceso se verifican, a grandes rasgos, las siguientes reacciones sobre la interfase solución/metal:
1) Me + 2 H3PO4 <=> Me(H2PO4)2 + H2
2) 3 Me(H2PO4)2 <=> Me3(PO4)2 + 2 H3PO4
Donde Me representa un metal (+2) como Zn, Mn, Fe, etc.
La reacción 1) representa el ataque al metal base con formación de una sal soluble en el baño fosfatizante.
La reacción 2) representa la formación de una sal neutra insoluble que se deposita sobre el metal base.
Ambas reacciones son reversibles, por lo tanto el desplazamiento del equilibrio hacia uno u otro lado depende de las condiciones operativas como concentración de reactivos, temperatura, etc. También debe haber un ajustado equilibrio entre la concentración de ácido fosfórico y la de la sal, ya que si el baño está demasiado diluido puede no lograrse la precipitación de los fosfatos neutros, y si la concentración es alta puede precipitar en forma abundante, formando un barro en la solución y polvillo en la superficie metálica.[30]
III) Sulfinizado: Se protege, por este método, al hierro y acero, sumergiéndolo en un baño salino constituido por sulfito de sodio, cloruro y cianuro de sodio, a una temperatura de más de 500 ºC.Se forma un sulfocianuro de sodio que cubre el metal, penetrando en el mismo, formando una capa de menos de medio milímetro de espesor.Las piezas sulfinizadas adquieren una enorme resistencia al desgaste.Por este motivo, se aplica el método de sulfinizado a las piezas para motores.
- C) Protección por coberturas orgánicas:
Este tipo de protección está constituido por pinturas, barnices y l Al secar, la pintura forma una película, que cubre la superficie pero es independiente de ésta y a diferencia del fosfatizado, no reacciona con el material de la superficie.
Las pinturas pueden ser al aceite, a la caserna o al látex. Sin considerarlas orgánicas, se debe mencionar a las pinturas anticorrosivas como las que contienen, como pigmento, minio (Pb3O4 , más exactamente ortoplumbato de plomo: Pb2(PbO4)) o bermellón (o cinabrio rojo, que es sulfuro mercúrico HgS y no es venenoso),(cromato básico de plomo: Pb2 (OH)2CrO4)my cuya acción protectora se debe, a la acción de los iones CrO4 y PbO4 de efecto oxidante.la luz.Los barnices forman películas más duras que las pinturas, pero son menos resistentes a la acción de El efecto de los barnices se mejora con el agregado de aceites de siliconas.Las lacas están constituidas por nitrocelulosa con resinas envolventes apropiadas (lacas de piroxilina).
- d) Protección catódica: El recubrimiento del hierro con cinc (galvanizado), es uno procedimiento de protección catódica, pues el potencial de reducción del cinc es inferior al del hierro y los electrones pasan a ést
La protección catódica de tuberías, cascos de buques y puentes, se logra formando pares de Fe/Zn o Fe/Mg.
En el caso de tuberías, se clavan barras de cinc o de magnesio en el suelo y se las pone en contacto
con la tubería.
Los electrones pasan del cinc al hierro de las tuberías, el cual queda protegido. En los cascos de los buques, se adhieren bloques de magnesio.
Estos bloques, debido a su menor potencial de reducción, se corroen, actuando como ánodos de sacrificio, protegiendo al hierro del casco. Dicha protección dura mientras no se consuma el magnesio.
Llegando ese caso, los bloques de magnesio son reemplazados. Oxidación: Mg(s) —-> Mg2+(aq) + 2e-
Reducción: O2 + 4H+(aq) + 4 e- —> 2H2O(l)[31]
INHIBIDORES
Inhibidor es toda sustancia que se agrega, en concentraciones pequeñas, a un medio para evitar la corrosión o disminuir la velocidad de la misma.Los inhibidores pueden ser sustancias orgánicas o inorgánicas. Algunos inhibdores actúan como neutralizantes.Así sucede con el hidróxido de sodio, que se agrega a; ácido sulfúrico de hecho permitiendo, de esta manera, el uso de cañerías de acero de fundición.Debe, además, considerarse la posibilidad de que un inhibidor beneficie a uno de los metales de una instalación y perjudique al otro. Por ejemplo, el amoníaco usado como inhibidor de la corrosión del acero por el ácido sulfúrico del petróleo, corroe a los conductos de bronce.
Hay muchos inhibidores: los fosfatos, silicatos y cromatos actúan sobre la zona anódica; las sales de cinc, níquel, arsénico y antimonio, actúan sobre la zona catódica.Cuando se agregan sales de cinc sucede lo siguiente: el oxigeno en la zona catódica produce con el agua, iones oxhidrilos.
Zona catódica: O2 + 2H2O + 4 e- —> 4 HO-
Estos iones oxhidrilos forman con los metales de las sales inhibidoras agregadas, hidróxidos, que a depositarse sobre la zona catódica, la protegen, impidiendo la acción del oxígeno en esta área, deteniendo el proceso de corrosión:
Zn2+ + 4 HO- —–> 2 Zn(OH)2(s)
(catión agregado) se deposita sobre la zona catódica
Pese a todo lo que se conoce sobre inhibidores, su selección es muy empírica. El inhibidor debe ser ensayado específicamente sobre cada caso particular.[30]
PASIVADORES
Son sustancias que producen una película no porosa e insoluble sobre las piezas metálicas, impidiendo la corrosión.Algunos metales como el aluminio, forman, en contacto con el aire, una película muy adherente y fina, de óxido que actúa como pasivador, impidiendo la posterior corrosión.Una solución de cromado de sodio se añade a menudo a sistemas refrigerantes y radiadores para prevenir la formación de óxido.El plomo presenta una resistencia grande al ácido sulfúrico en concentraciones debajo del 60%.El ácido sulfúrico forma con el plomo sulfato de plomo, que se deposita sobre éste, formando una película que lo protege de la corrosión posterior.Este es otro caso que ejemplifica cómo el producto de la corrosión sirve para autoproteger al metal.
El cromo, níquel, hierro, etc. pueden volverse pasivos por acción del ácido nítrico que provoca sobre ellos formación de una fina película de óxido, como la que forma el aluminio en forma espontánea.Si se hace actuar al ácido nítrico concentrado sobre el cromo, la capa de óxido de cromo vuelve al metal, inerte ante los reactivos químicos.Colocando luego, al metal en una solución de ácido sulfúrico diluido con cinc, el hidrógeno naciente, reduce al óxido depositado y el metal se vuelve de nuevo activo, siendo atacado por los ácidos.Los metales se pueden pasivar colocándolos como ánodos en las cubas electrolíticas. Sobre ellos se desprende el oxígeno que los recubre con una película que los torna inatacables por los ácidos.Los metales pasivados modifican su potencial de electrodo cambiando su posición en la serie electroquímica, hasta ubicarse con un potencial similar a los metales nobles.Este procedimiento se denomina anodización.El proceso se puede completar con la adición de colorantes que hacen que las piezas anodizadas adquieran hermosos colores.Para terminar se debe aclarar que el término pasividad es relativo.
Un acero inoxidable puede comportarse como pasivo en ácido nítrico y agua, pero será atacado por el ácido clorhídrico.Es decir, un metal o aleación es pasivo o activo, únicamente en relación a determinado medio exterior.[30]
9.3 PROCESOS INDUSTRIALES DE RECUBRIMIENTO
9.3.1 Introducción.
Durante muchos años nuestra sociedad de consumo ha exigido mejores condiciones de vida paralelas a sus necesidades crecientes y esto ha generado un formidable desarrollo industrial al cual se le ha invertido mucho tiempo de estudio en el diseño y construcción de plantas, equipos e instalaciones industriales de procesos para la síntesis y manufactura de productos que satisfagan dichas necesidades. Hoy día con día se desarrollan nuevos procesos, nuevos productos, nuevas necesidades las cuales ponen a prueba la creatividad e inventiva del hombre.
Protección catódica.
El proceso de corrosión del Acero considera un flujo de electrones que abandonan la superficie metálica con la consecuente disolución del Acero en forma de iones Fe++. Durante la protección catódica a través de un circuito eléctrico externo o sistema de nodos de sacrificio, se imprime corriente a la superficie metálica invirtiendo el sentido del flujo de electrones y evitando así la disolución del fierro. Este método se utiliza preferentemente en tuberías y estructuras enterradas o sumergidas.
Los electrones para protección catódica puede suministrarse mediante:
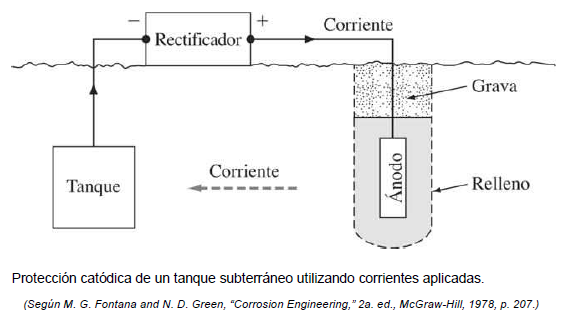
1) una fuente de potencia de CD externa, como se muestra en la Figura 13.
figura 13.protección catódica de un tanque subterráneo utilizando corrientes aplicadas [35]
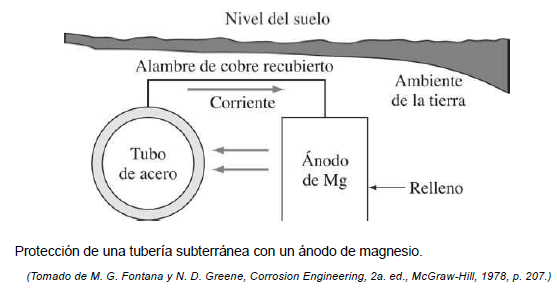
2) un acoplamiento galvánico con un metal más anódico que el que se está protegiendo. La protección catódica de un tubo de acero mediante acoplamiento galvánico a un nodo de magnesio se ilustra en la figura 14 .Los ánodos de magnesio que se corroen en lugar del metal que se protege se usan más comúnmente en la protección catódica debido a sus altos potencial negativo y densidad de corriente.
figura 14. protección de un tubería subterránea con un ánodo de magnesio [35]
Protección anódica.
es relativamente nueva y se basa en la formación de películas pasivas protectoras sobre superficies metalicas y de aleaciones aplicando externamente corrientes anódicas. Es posible aplicar corriente anódicas controladas con cuidad de mediante un dispositivo llamado potenciostato para proteger metales que se pasivan tales como los aceros inoxidables austeníticos, con el fin de hacerlos pasivos y en consecuencia reducir su velocidad de corrosión en un ambiente corrosivo.
Ventajas de la protección anódica: es posible aplicarla en condiciones de muy poco a muy corrosivas, ya que demandan corrientes aplicadas muy pequeñas, una desventaja de la protección anódica
Desventaja se necesita instrumentación compleja y su costo de instalación es alto
Inhibidores de la corrosión.
Este método considera el uso de pequeñas cantidades de compuestos orgánicos o inorgánicos incapaces de formar una película o barrera adherente en la superficie del Acero por atracción eléctrica o por una reacción, evitando el acceso de los agentes corrosivos.
Estos compuestos se caracterizan por las altas cargas eléctricas en los extremos de sus moléculas capaces de ser atraídas por la superficie a proteger; desafortunadamente esta atracción no es permanente siendo necesaria una dosificación constante en el medio. Este método se utiliza preferentemente en donde existen medios fluidos de recirculación.
Uso de recubrimientos anticorrosivos.
Este método al igual que el anterior considera la formación de una barrera que impida en lo posible el acceso de los agentes corrosivos a la superficie metálica; no obstante, la barrera es formada a partir de la aplicación de una dispersión liquida de una resina y un pigmento, con eliminación posterior del solvente, obteniéndose una película sólida adherida a la superficie metálica. Su durabilidad está condicionada a la resistencia que presente esta película al medio agresivo. Su uso está muy generalizado en la protección de estructuras e instalaciones aéreas o sumergidas.
Selección de materiales de construcción
Cuando las condiciones de presión y temperatura sean muy extremas o bien el medio sea excesivamente agresivo en tal forma que los métodos anteriores no sean utilizables se puede recurrir a una selección adecuada de materiales (generalmente caros). La alta resistencia a la corrosión de estos materiales se basa en la formación inicial de una capa delgada de oxido del metal y muy adherente e impermeable. A este fenómeno se le conoce como Pasivación. Afortunadamente la frecuencia en el uso de este método es menor en las instalaciones de la industria. Considerando el aspecto económico de cada uno de estos métodos así como sus limitaciones, las cuales necesariamente repercuten en su eficiencia de protección se concluye que la solución a los problemas de corrosión está enfocada a su control más que a su eliminación. Cada uno de los métodos mencionados constituye una extensa área de estudio dentro de la ingeniería de corrosión, existiendo gran cantidad de publicaciones y bibliografía en cada caso. En el presente seminario se considera únicamente lo concerniente a Recubrimientos Anticorrosivos.
El uso de recubrimientos anticorrosivos para la protección de instalaciones industriales constituye una de las practicas mas comunes en el control de corrosión, tanto por su versatilidad de uso como por su bajo costo relativo. A la fecha se han desarrollado gran diversidad de recubrimientos caracterizados fundamentalmente por el tipo de resina y pigmento utilizados en su formulación; generalmente un aumento de eficiencia va aunada a un aumento de costo, por lo que, la selección del tipo de recubrimiento para un caso especifico debe ser el resultado de un balance técnico económico. De lo anterior es posible inferir que la investigación actual en este campo está orientada a recubrimientos anticorrosivos de alta eficiencia y bajo costo [21].
9.3.2 Niquelado electrolítico.
El niquelado electrolítico es un proceso que consiste en la deposición por vía electrolítica del metal níquel sobre una superficie previamente acondicionada que puede ser acero, cobre, latón y zamak. Con un espesor variable según las necesidades, tiene como objetivo mejorar las propiedades técnicas y decorativas del material base.
Ventajas.
Las principales ventajas para realizar deposición electrolítica de níquel sobre piezas son:
- Protección contra la corrosión: incrementa la resistencia a la corrosión del material base como capa intermedia o final.
- Mejora de las cualidades técnicas: aumenta la conductividad eléctrica, dureza y resistencia a la abrasión, entre otras cualidades.
- Recubrimiento altamente decorativo: Proporciona un aspecto de gran brillo, nivelación y ductilidad.
Aplicaciones
El níquel como elemento protector, tiene un campo de aplicación muy extenso empleándose, como elemento protector y como revestimiento ornamental de los metales, en especial de los que son susceptibles de corrosión como el hierro y el acero, asimismo aumentando su conductividad eléctrica. También es utilizado como pre capa para otros tratamientos. Su aplicación se ha extendido a todo tipo de sectores como de coletaje, ferretería, material eléctrico, electrónica, automoción, estampación metálica, material de saneamiento y grifería [22].
9.3.3 Recubrimiento metálico de cromo.
El cromo es un metal muy difícil de trabajar en frío porque es muy duro y quebradizo, en caliente es igual de difícil porque se oxida con una capa de oxido de cromo dura e infusible. Por estas razones el cromo no se suele emplear como metal puro salvo en ocasiones muy raras aunque eso si, entra a formar parte de muchas aleaciones. Especialmente es aleado con el hierro porque mejora su dureza y resistencia a la corrosión. El acero inoxidable contiene entre un 8 y un 12 % de cromo, y es el principal responsable de que sea inoxidable. Muchas herramientas están fabricadas con aleaciones de hierro cromo y vanadio. El nicromo o cromo-níquel se emplea para fabricar resistencias eléctricas.
Debido a las dificultades de la metalurgia de cromo cuando es necesario aplicarlo se emplean básicamente dos procedimiento, sputering y recubrimiento electrolítico. El recubrimiento electrolítico con cromo es extensivamente usado en la industria para proteger metales de la corrosión y mejorar su aspecto. También se emplea para restaurar piezas metálicas o conseguir superficies muy duraderas y con bajo coeficiente de rozamiento (cromo duro).
El llamado cromo duro son depósitos electrolíticos de espesores relativamente grandes (0,1 mm) que se depositan en piezas que deben soportar grandes esfuerzos de desgaste. Se realizan este tipo de depósitos especialmente en asientos de válvulas, cojinetes cigüeñales ejes de pistones hidráulicos y en general en lugares donde se requiera bastante precisión. El cromo duro se emplea especialmente en el rectificado de motores de explosión. Los cigüeñales y otras piezas fundamentales de los motores de explosión sufren desgastes que se manifiestan como holguras en sus rodamientos y que pueden comprometer su funcionamiento. Por ello antes de que exista una rotura grave se reponen las partes de metal perdidas mediante cromo electrolítico. Generalmente la capa de cromo depositada no es totalmente uniforme por lo cual se da espesor mayor del necesario y después se rectifican las piezas para conseguir las dimensiones y acabado adecuados.
El cromo brillante o decorativo son finas capas de cromo que se depositan sobre cobre o níquel para mejorar el aspecto de algunos objetos. El famoso niquelado para golpes y otros embellecedores de coche suele consistir en una capa de níquel terminada con un Flash de cromo de algunas micras de espesor. El color del cromo es mas azulado y reflectante que el níquel y es mucho mas resistente a la corrosión ya que inmediatamente se forma una fina e imperceptible capa de oxido que protege al metal.
El cromo tiene poco poder cobertor, menos aun si las capas que se depositan son tan finas como una micra. Por ello las superficies a cubrir deben estar bien pulidas, brillantes y desengrasadas ya que el cromo no va a tapar ninguna imperfección. Es por esto por lo que frecuentemente las piezas que se croman con objeto decorativo se recubren con cobre y níquel antes de ser cromadas. El cromo se aplica bien sobre el cobre el níquel y el acero, pero no sobre el zinc o la fundición.
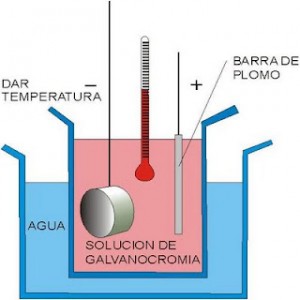
Para conseguir un baño electrolítico de cromo se disuelve ácido crómico en agua en una proporción de 300 gramos por litro y se añade 2 gramos por litro de ácido sulfúrico. Se emplea como ánodo un electrodo de plomo o grafito. El plomo sirve como ánodo porque se forma una placa de oxido de plomo que es conductor pero que impide que se siga corroyendo por oxidación anódica. Al contrario que en otros baños como los del níquel el cromo que se deposita en el cátodo procede del ácido crómico disuelto y no del ánodo, por lo que poco a poco se va empobreciendo en cromo la solución. Con el uso el cromo se va agotando y hay que reponerlo añadiendo más ácido crómico [23].
El ácido crómico se descompone por la corriente eléctrica en cromo metálico que se deposita en el cátodo y oxígeno que se desprende en el ánodo. El ácido crómico (en realidad es un anhídrido soluble en agua) contiene aproximadamente un 50% en cromo metálico, esto significa que para que un litro de baño pierda solo un 10 % de concentración tienen que haberse depositado 15 gramos de cromo. Lo cual equivale a recubrir una superficie de aproximadamente dos metros cuadrado con una capa de cromo de 1 micras, mas que suficiente para efectos decorativos [24].
Figura 15. Medición temperatura solución de galvanocromia [23].
Baños para cromo decorativo.
Acido crómico comercial 200 a 300 gr/ litro
Acido sulfúrico 1 a 3 gr /litro
Temperatura de trabajo de 36¡5 a 45 ºC
Densidad de corriente de 6 a 12 A/dm2
Baños para cromo duro.
Acido crómico comercial 250 a 400 gr/ litro
Acido sulfúrico 1 a 2 gr /litro
Temperatura de trabajo de 45 a 65 ºC
Densidad de corriente de 15 a 50 A/dm2 [24].
9.3.4 Cobreado ácido.
Soluciones ácidas:
El cobreado ácido se efectúa a partir de una solución que consiste fundamentalmente en sulfato de cobre y ácido sulfúrico. Este tipo de soluciones tiene un bajo costo de preparación y los rendimientos anódicos y catódicos llegan al ciento por ciento en muchos casos.
El depósito de cobre logrado con este tipo de soluciones suele ser de color mate, y si se precisa una superficie brillante, requiere un considerable trabajo de “afino”.
Es preciso limpiar mucho más cuidadosamente el metal de base antes de proceder al cobreado en baño ácido de lo que precisan las soluciones de cianuro, pues, a diferencia de estas últimas, la solución de sulfato no posee propiedades detergentes.
La presencia del ácido sulfúrico es esencial, pues evita la formación de precipitados de sales básicas de cobre y también aumenta la ionización y, por consiguiente aumenta la conductividad de la solución, reduce la posibilidad de que los electrodos se polaricen y ahorra el consumo de fuerza. Reduciendo la concentración de iones cobre de la solución, el ácido tiene también el efecto de producir depósitos lisos de pequeño tamaño de grano.
Comúnmente, se utilizan densidades de corriente de 2 a 6,5 amperios por dm². Las soluciones de cobre trabajan usualmente a temperatura ambiente, aunque a veces se utilizan temperaturas hasta de 50 °C. La elevación de la temperatura da lugar a la obtención de un depósito de cobre más blando. La agitación con aire aumenta la densidad de corriente que pueda utilizarse.
Se utilizan cubas de acero recubiertas de goma. La parte exterior de la cuba debe recibir un tratamiento con pintura asfáltica anti-sulfúrica, puesto que la solución es muy corrosiva.
Los contaminantes más comunes en los baños al sulfato provienen de la descomposición de los abrillantadores (orgánicos), o por impurezas metálicas (sales con impurezas, cubas metálicas con recubrimiento defectuoso, etc.). En ambos casos, las características del depósito se ven alteradas. En el caso de las impurezas orgánicas, se debe tratar con carbón activado. En casos de contaminaciones severas, se debe tratar con agua oxigenada, o con permanganato de potasio. Una vez descompuestos los contaminantes orgánicos, se debe tratar finalmente con carbón activado.
A continuación se presentan los dos baños basados en soluciones ácidas más utilizados junto con sus características particulares:
Baños de cobre al sulfato convencionales: Estos baños resultan económicos de preparar, de operar y de neutralizar (tratamiento de aguas residuales).
Los componentes químicos básicos de una solución de cobre ácido son el sulfato de cobre y el ácido sulfúrico. Estas sales son altamente conductoras de electricidad y se disocian con facilidad, pudiendo así trabajar con densidades de corriente suficientemente elevadas.
Las piezas de hierro, deben ser cubiertas con una película previa de cobre alcalino o de un depósito de níquel “Strike”, para evitar desprendimientos de las películas depositadas por oxidación del metal de base. Los baños normalmente se operan a temperatura ambiente.
En las soluciones semibrillantes y brillantes, el agente de adición utilizado para lograr este fin es la thiourea, que debe ser adicionada en cantidades exactas, ya que el exceso de este producto, favorecerá la polarización anódica, disminuyendo el rendimiento por el menor pasaje de corriente eléctrica y por la caída en el régimen de disolución anódica.
Se aconseja el tratamiento de las soluciones de cobre ácido que contengan este tipo de aditivo, ya que el mismo tiende a descomponerse con o sin el uso del electrolito. La forma más conveniente de evitar esto es realizar un tratamiento preventivo de la solución con carbón activado en forma total y periódica.
Por lo general, para realizar baños de cobre ácido sobre material ferroso, se aconseja un baño previo de cobre alcalino (flash o strike).
Se puede realizar un buen depósito de cobre ácido directamente sobre hierro, siempre y cuando el mismo haya sido inmerso un breve tiempo en una solución diluida de ácido arsenioso, que puede ser sustituida también por una sal de plomo o de antimonio.
Baños de cobre acido “UBAC” (Udylite Brigt Acid Cooper): El empleo del proceso “UBAC” produce depósitos de cobre de alto brillo, con excelente ductilidad y gran poder de nivelación.
Las propiedades atribuidas a este proceso, pueden ser resumidas en los seis puntos siguientes:
1. Los depósitos obtenidos poseen excelentes características de nivelación.
2. El depósito resulta de brillo especular trabajando en el rango de densidades de corriente normalmente empleadas. Puede ser niquelado y cromado directamente sin necesidad de repulido.
3. Las películas de cobre obtenidas mediante este proceso pueden ser repulidas fácilmente.
4. Los depósitos poseen ductilidad excepcional.
5. No se originan productos nocivos de descomposición durante la electrólisis, y el agente de adición no se deteriora con el tiempo.
6. La solución es muy fácil de controlar, ya que posee un solo agente de adición.
El aspecto más importante en el funcionamiento de este proceso consiste en la selección del tipo de ánodos. Es indispensable que los ánodos posean una determinada concentración de fósforo para poder obtener resultados óptimos con el proceso “UBAC”.
El empleo de ánodos de material inadecuado dará lugar a la formación de grandes cantidades de iodo, que origina asperezas y picados. Es esencial una vigorosa agitación por aire, ya que la falta de ella daría lugar a la formación de depósitos “quemados” en las zonas de alta densidad de corriente, y poco uniformes en las de baja densidad.
En caso de que se desee obtener depósitos realmente lisos, es esencial efectuar una buena filtración. Para ello se requiere normalmente el empleo de papeles de filtro y un caudal mínimo por hora equivalente al del volumen del baño.
Estos baños de cobre, al igual que los procesos de cobre ácido convencionales, presentan un excelente poder de cobertura o micro penetración. En las piezas de fundición, no se han evidenciado dificultades para ser cobreadas con este tipo de soluciones. Otra ventaja del “UBAC” con relación a las piezas de fundición es que posee muy buena nivelación comparada con la nivelación negativa característica de la mayoría de los procedimientos de cobre alcalino cianurado. Además, posee gran tolerancia a la contaminación con cinc. De hecho, este proceso llega a trabajar satisfactoriamente con iguales concentraciones de cinc en solución que de cobre.
Otra interesante aplicación de este baño es que, según está comprobado, una delgada capa de cobre “UBAC”, aumenta la excelente resistencia a la corrosión en un depósito triple compuesto por Níquel brillante, “Níquel-Seal” y Cromo.
Las reacciones involucradas en este tipo de recubrimiento para el cobre acido son básicamente de oxido-reducción y se muestran a continuación, pero primero el sulfato de cobre se disocia en el baño:
En la siguiente figura se muestran los tipos de complejos que se pueden formar en los baños de Cobre ácido, además se observa que la concentración de iones Cu2+ va disminuyendo conforme aumenta el pH; es por ello que este tipo de baños se opera a pH de 4.5 en donde la concentración de iones Cu2+ es casi constante. Los otros tipos de complejos formados, que se pueden afectar en cierta medida el recubrimiento, se hacen reaccionar en algunos casos con los compuesto que constituyen los aditivos para lograr de esta forma darle brillo y uniformidad al recubrimiento [25].
Figura 16. Cobreado de un objeto en una solución acida [25].
Soluciones de cianuro:
El baño de cobre cianurado, a pesar de los peligros que involucra su operación para la salud, y por sus desechos provenientes de aguas de enjuague, aún sigue siendo en algunos casos una opción insustituible.
Se recomienda la utilización de las formulaciones conteniendo sales potásicas, ya que aumentan considerablemente el rango de trabajo de las soluciones.
Los ánodos para todos los baños deben ser de cobre de la mayor pureza posible, libres de óxido. Ellos pueden ser laminados o elípticos. En algunas aplicaciones, es aconsejable utilizarlos con fundas.
Este tipo de solución se utiliza casi exclusivamente cuando se aplica el cobre como recubrimiento previo para el niquelado. El baño de cianuro consiste esencialmente en una solución de cobre en cianuro sódico o potásico, con un exceso de este último.
La solución trabaja normalmente a unos 32 a 38° C, con densidades de corriente de hasta 2 amperios por dm2. Una cantidad excesiva de cianuro da por resultado una gran proporción de hidrógeno desprendido, con la consiguiente disminución del rendimiento de corriente, y puede ser causa del levantamiento de los depósitos.
Cuando el contenido en carbonato llega a ser muy elevado, es de aconsejar la eliminación del exceso, ya sea apartando una parte de la solución, o todavía mejor, refrigerando la solución ligeramente por debajo de 0° C, con lo cual la mayoría del carbonato se separa por cristalización. Un nuevo método para la eliminación del exceso de carbonato consiste en el agregado de carburo de calcio. El carburo reacciona con el agua para formar hidróxido de calcio, que a su vez precipita el carbonato como carbonato de calcio. El lodo puede eliminarse por decantación y lavado.
Otros contaminantes son los orgánicos que causan un depósito poco uniforme, rugoso, picado y/o falto de cuerpo. En casos severos de contaminación orgánica suelen polarizarse los ánodos (se cubren con una película no conductora de sales de cobre), disminuyendo por consiguiente el flujo de corriente eléctrica. La alternativa válida para la recuperación del electrolito es el agregado de carbón activado, y posterior filtrado.
El cromo hexavalente, como contaminante, provoca depósitos incompletos en la zona de baja densidad de corriente. Los sulfuros producen coloraciones rojizas en las zonas de baja densidad de corriente. Pequeñas adiciones de cianuro de cinc, eliminan el contenido de sulfuro en los electrolitos.
Las soluciones de cianuro se aplican comúnmente en cubas de acero, aunque más recientemente se ha incrementado el uso de cubas recubiertas de goma.
Existen diferentes tipos de baños con los que se trabajan, algunos de ellos se detallan a continuación:
Baños de Cobre tipo «Strike» multipropósito: La finalidad principal de estos baños es la de depositar una película de cobre de gran adherencia, activar substratos pasivos, o como paso de seguridad luego del proceso de limpieza.
Los depósitos de los baños de cobre «Strike», normalmente están en el rango de espesores de 0,5 a 2,0 µm.
Existen dos formulaciones, una basada en sales sódicas y otra en sales potásicas, y ambas son de uso general. Según algunos autores, las sales potásicas admiten un rango de corriente mayor que las de sodio.
Este baño «Strike» de cobre, es uno de los más utilizados para el bañado del aluminio tratado con una solución de cincato (tratamiento previo). También puede ser usado sobre piezas de cinc y sus aleaciones, y diversos metales que pueden ser atacados por la acción de los distintos productos químicos o componentes de los demás baños.
El uso de la sal de Rochelle (tartrato doble de sodio y potasio), le confiere a la solución características de alta velocidad de depósito.
Baños de Cobre de alta eficiencia: Estos tipos de electrolitos están formulados para obtener depósitos de gran espesor, con un régimen de depósito veloz.
Se pueden obtener mejoras en el brillo mediante el agregado de aditivos o agentes inorgánicos a la solución de cobre. Dentro de los posibles, se encuentran el sulfito, bisulfito e hiposulfito de sodio.
El abrillantado puede lograrse también mediante la interrupción de corriente en intervalos repetitivos, o con equipos de corriente periódicamente reversa (PRC), con lo cual, también se mejoran las características del depósito electrolítico respecto a su estructura cristalina y granular. En esencia el procedimiento consiste en invertir periódicamente la corriente utilizando un ciclo relativamente lento. El ciclo exacto de inversión periódica se determina en cada caso experimentalmente, pero el más corriente es uno de 20 segundos de recubrimiento seguido de otro de 5 segundos de disolución a densidades de corriente muy elevadas. Aunque es obvio que este procedimiento tiene un rendimiento bajo por ciclo que otro con corriente continua normal, las elevadas densidades de corriente que pueden utilizarse significan que puede reducirse considerablemente el tiempo total invertido en obtener un recubrimiento de un espesor determinado [26].
9.3.5 Galvanizado en caliente.
La técnica de galvanizado en caliente se ha utilizado por más de 100 años para la protección del acero en contra de la corrosión. Evitar la corrosión es de suma importancia en la industria, ya que los metales corroídos presentan mayores averías, quebraduras y rompimientos. Es por esto, que el galvanizado en caliente es uno de los métodos más utilizados hoy en día para la protección de los metales.
El proceso de galvanizado al caliente (Figura 17) es bastante sencillo. La película protectora del acero se forma al sumergir los productos de acero en zinc fundido. Esta película de zinc protege el acero de dos maneras, protección de barrera y protección galvánica. Éste último, permite que las piezas de acero permanezcan libres de corrosión por largos años [27].
Figura 17. Galvanizado en caliente [27].
9.3.6 Galvanizado electroquímico.
Es el proceso electroquímico por el cual se puede cubrir un metal con otro. Se denomina galvanización pues este proceso se desarrolló a partir del trabajo de Luigi Galvani, quien descubrió en sus experimentos que si se pone en contacto un metal con una pata cercenada a una rana, ésta se contrae como si estuviese viva, luego descubrió que cada metal presentaba un grado diferente de reacción en la pata de rana, por lo tanto cada metal tiene una carga eléctrica diferente.
Más tarde ordenó los metales según su carga y descubrió que puede recubrirse un metal con otro, aprovechando esta cualidad (siempre depositando un metal de carga mayor sobre otro de carga menor).
De su descubrimiento se desarrolló más tarde el galvanizado, la galvanotecnia, y luego la galvanoplastia.
La función del galvanizado es proteger la superficie del metal sobre el cual se realiza el proceso. El galvanizado más común consiste en depositar una capa de zinc (Zn) sobre hierro (Fe); ya que, al ser el zinc más oxidable, menos noble, que el hierro y generar un óxido estable, protege al hierro de la oxidación al exponerse al oxígeno del aire. Se usa de modo general en tuberías para la conducción de agua cuya temperatura no sobrepase los 60 °C ya que entonces se invierte la polaridad del zinc respecto del acero del tubo y este se corroe en vez de estar protegido por el zinc. Para evitar la corrosión en general es fundamental evitar el contacto entre materiales disímiles, con distinto potencial de oxidación, que puedan provocar problemas de corrosión galvánica por el hecho de su combinación. Puede ocurrir que cualquiera de ambos materiales sea adecuado para un galvanizado potencial con otros materiales y sin embargo su combinación sea inadecuada, provocando corrosión, por el distinto potencial de oxidación comentado.
Uno de los errores que se comete con más frecuencia es el del empleo de tuberías de cobre combinadas con tuberías de acero galvanizado (vid. normas UNE 12502.3, UNE 112076, UNE 112081). Si la tubería de cobre, que es un material más noble, se sitúa aguas arriba de la de galvanizado, los iones cobre, que necesariamente existen en el agua o las partículas de cobre que se puedan arrastrar por erosión o de cualquier otra procedencia, se cementarán sobre el zinc del galvanizado aguas abajo y éste se oxidará por formarse una pila bimetálica local Cu/Zn en los puntos en los que los iones cobre se hayan depositado como cobre metálico sobre el galvanizado. A partir de ese momento se acelerará la corrosión del recubrimiento galvanizado en todos esos puntos. Desaparecido el zinc del recubrimiento, la pila será Cu/Fe y continuará corroyéndose hasta perforarse el tubo de acero. Como el galvanizado está instalado anteriormente este fallo pasa desapercibido y se suele atribuir al fin de la vida en servicio o, incluso, a la mala calidad del galvanizado. La causa, sin embargo ha sido la mala calidad del diseño: la instalación de la tubería de cobre aguas arriba, que es la que ha provocado la corrosión del galvanizado, aguas abajo. Por el contrario, en el caso de que las tuberías de cobre se instalen al final de la red, es decir, aguas abajo de la tubería de galvanizado, no existe ese problema siempre que se garantice que no haya agua de retorno que después de pasar por el cobre pase por el galvanizado. Si existe ese riesgo se deberá colocar un sistema anti retorno. En cualquier caso, es necesario colocar un manguito aislante entre el acero galvanizado de la instalación general y la tubería de cobre final para evitar el contacto galvanizado/cobre. Esta solución, sin embargo, es ineficaz en el caso anterior, tubería general de cobre y ramales finales de acero galvanizado. Aunque se elimine la corrosión en el punto de contacto entre ambos materiales, que es lo único que hace el manguito, no se evitará la corrosión. Ésta se producirá debido a los iones cobre que transporta el agua, o las partículas de cobre, que producirán picaduras sobre toda la instalación de galvanizado aguas abajo, tal como se ha explicado.
Otros procesos de galvanizado muy utilizados son los que se refieren a piezas decorativas. Se recubren estas piezas con fines principalmente decorativos, las hebillas, botones, llaveros, artículos de escritorio y un sinfín de productos son bañados en cobre, níquel, plata, oro, bronce, cromo, estaño, etc. En el caso de la bisutería se utilizan baños de oro (generalmente de 18 a 21 quilates). También se recubren joyas en metales más escasos como platino y rodio [28].
Figura 18. Galvanizado electroquímico [28].
9.3.7 Galvanizado por inmersión.
La inmersión en metal fundido. Consiste en sumergir el metal que se va a recubrir en otro metal de menor punto de fusión, en estado fundido. La aplicación más importante la constituye el recubrimiento de objetos, chapas, barras y alambres de acero con zinc, y el recubrimiento de acero, cobre y latón con estaño. En menor extensión se aplica también por este procedimiento el aluminio, para el que resulta necesario efectuar el recubrimiento en atmósfera de hidrógeno. En este proceso hay que regular la temperatura y el tiempo para lograr cierta disolución del metal que se va a recubrir, en el metal fundido, con objeto de que se forme una capa intermedia de aleación de ambos metales que dé lugar a una buena adherencia del recubrimiento, pero el espesor de la capa de aleación no debe ser tan grande que origine una película frágil. Los espesores que se obtienen por este procedimiento son relativamente gruesos comparados con los que se obtienen por otros métodos, y presentan menos poros. Sin embargo, tanto el espesor como la uniformidad del recubrimiento son difíciles de regular.
Tiene como principal objetivo evitar la oxidación y corrosión que la humedad y la contaminación ambiental pueden ocasionar sobre este hierro. Esta actividad representa aproximadamente el 50% del consumo de zinc en el mundo y desde hace más de 150 años se ha ido afianzando como el procedimiento más fiable y económico de protección del hierro contra la corrosión [29].
9.4 VELOCIDAD DE CORROSIÓN
La cantidad de metal que se corroe de manera uniforme en un ánodo o que se electrodeposita en un cátodo en una solución acuosa en cierto tiempo se determina utilizando la ecuación de faraday e la quimica general, la cual establece que.
Donde:
w: peso de metal, g, corroído o electrodepositado en una solución acuosa en el tiempo t [s].
I: flujo de corriente, A.
M: masa atómica del metal, g/mol.
n: número de electrones/átomo producidos o consumidos en el proceso
F: constante de Faraday=96 500 C/mol 96 500 A. S/mol.
Algunas veces la corrosión acuosa uniforme de un metal se expresa en términos de una densidad de corriente i, que a menudo. Se expresa en amperes por centímetro cuadrado. Al sustituir I por iA la ecuación anterior se convierte en:
Donde i es la densidad de corriente, A/cm^2 y A el área en cm^2, si se usa el centímetro para la longitud. Las otras cantidades son las mismas que en la primer ecuación.
9.4.1 pasivación
La pasivación de un metal respecto a la corrosión se refiere a la formación de una capa superficial protectora de productos de la reacción que inhibe las reacciones adicionales. En otras palabras, la pasivación de dos metales. Se refiere a la pérdida de su reactividad química en presencia de una condición ambiental específica. Muchos metales y aleaciones importantes para la ingeniería se vuelven pasivos y por tanto muy resistentes a la corrosión en ambientes oxidantes. De moderados a intensos. Ejemplos de los metales y aleaciones que muestran pasividad son los aceros inoxidables, el níquel y muchas de sus aleaciones, así como el titanio y el aluminio junto con numerosas aleaciones de los mismos.
Existen dos teorías principales relativas a la naturaleza de la película pasivada:
- la teoría de la película de oxido: se cree que la película pasivada constituye una capa de barrera para la difusión de los productos de la reacción, es decir, óxidos metálicos u otros compuestos, que separan al metal de su ambiente y retardan la velocidad de la reacción.
- la teoría de la adsorción: se cree que los metales pasivados son cubiertos por películas de oxigeno que se absorben químicamente. Se supone que una capa de este ion desplaza las moléculas O absorbidas normalmente y retardan la velocidad de la disolución anódica que implica la hidratación de iones metálicos.
Ambas teorías tienen en común. Una película protectora que se forma sobre la superficie metálica para crear el estado pasivado, lo cual origina una mayor resistencia a la corrosión.
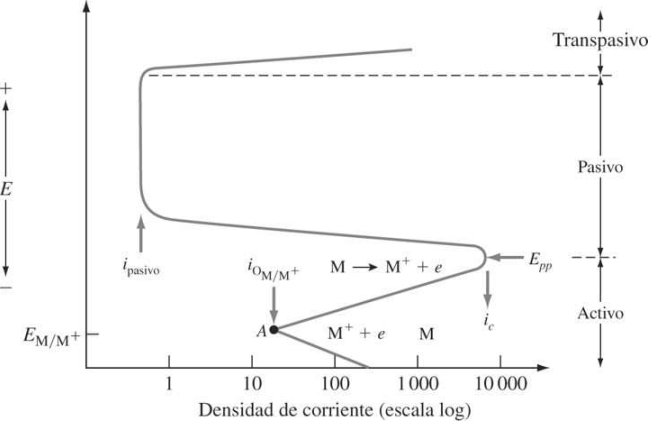
La pasivación en los metales en términos de la velocidad e corrosión se ilustra mediante una curva de polarización que indica como varia el potencial de un metal con la densidad de corriente como se muestra en la figura. Se considerara el comportamiento de pasivación. De un metal M cuando se aumenta la densidad de corriente. En el punto A de la figura el metal está en su potencial de equilibrio E con su densidad de corriente de intercambio Cuando el potencial del electrodo se hace mas positivo, el me tal se comporta como un metal activo. Y su densidad de corriente, y consecuencia, su velocidad de disolución aumentan en forma exponencial.
Cuando le potencial se vuelve más positivo y alcanza el potencial el potencial pasivo primario, la densidad de corriente y en consecuencia la velocidad de corrosión disminuyen hasta un valor bajo indicado como en el potencial , el metal forma una película protectora. Sobre su superficie. Que causa la reactividad disminuida. Cuando el potencial se hace aun más positivo. La densidad de corriente permanece en sobre la region pasivada. Un mayor aumento en el potencial mas allá de la región pasivada hace que el metal vuelva a ser activo, y la densidad de corriente aumenta en la región transpasivada.
figura 19 Curva de polarización de un metal pasivo.[35]
9.5 VELOCIDADES DE OXIDACIÓN (CINÉTICA)
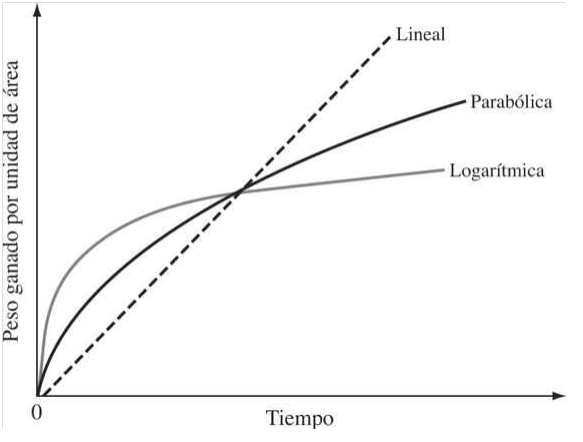
Desde el punto de vista de la ingeniería, la velocidad a la cual se oxidan los metales y aleaciones es muy importante puesto que la velocidad de oxidación de muchos metales y aleaciones determina la vida útil del equipo. La velocidad de oxidación de metales y aleaciones suele medirse y expresarse como el peso ganado por unidad de área. Durante la oxidación de diferentes metales, se han observado varias leyes de velocidad empíricas. Algunas de las comunes se presentan en la Figura 20.
Figura 20 ley de velocidad logarítmica.[35]
La velocidad de oxidación más simple cumple la ley lineal
Donde
w = peso ganado por unidad de área
t = tiempo
k L = constante de velocidad lineal
El comportamiento lineal de la oxidación se muestra mediante metales que tienen películas de óxido porosas o agrietadas, y por ello el transporte de los iones reactantes ocurre a velocidades más rápidas que la reacción química. Ejemplos de metales que se oxidan linealmente son el potasio, que tiene un cociente en volumen óxido-metal de 0.45, y el tantalio, con un cociente de2.50. Cuando la difusión de iones es la etapa que controla la oxidación de metales, los metales puros deben seguir la relación parabólica
w = ganancia en peso por unidad de área
t = tiempo
k p = constante de velocidad parabólica
C = una constante
Muchos metales se oxidan de acuerdo con la ley de velocidad parabólica, y éstos suelen asociarse con óxidos coherentes gruesos. El hierro, el cobre y el cobalto son ejemplos de metales que muestran comportamiento de oxidación parabólica.
Algunos metales como Al, Cu y Fe se oxidan a temperaturas ambiente o ligeramente altas para formar películas delgadas que cumplen con la ley de velocidad logarítmica.
![]() Donde C y A son constantes y k es la constante de velocidad logarítmica. Estos metales cuando se exponen al oxígeno a temperatura ambiente se oxidan muy rápido al principio, pero luego de unos cuantos días de exposición, la velocidad disminuye a un valor muy bajo. Algunos metales que exhiben comportamiento de velocidad lineal tienden a oxidarse catastróficamente a altas temperaturas debido a rápidas reacciones exotérmicas en sus superficies. Por tanto, en su superficie ocurre una reacción en cadena que causa que aumenten la temperatura y la velocidad de la reacción. Metales como el molibdeno, tungsteno y vanadio
Donde C y A son constantes y k es la constante de velocidad logarítmica. Estos metales cuando se exponen al oxígeno a temperatura ambiente se oxidan muy rápido al principio, pero luego de unos cuantos días de exposición, la velocidad disminuye a un valor muy bajo. Algunos metales que exhiben comportamiento de velocidad lineal tienden a oxidarse catastróficamente a altas temperaturas debido a rápidas reacciones exotérmicas en sus superficies. Por tanto, en su superficie ocurre una reacción en cadena que causa que aumenten la temperatura y la velocidad de la reacción. Metales como el molibdeno, tungsteno y vanadio
que tiene óxidos volátiles es posible que se oxiden de manera catastrófica. Además, las aleaciones que contienen molibdeno y vanadio inclusive en pequeñas cantidades presentan con frecuencia oxidación catastrófica que limita su uso en atmósferas oxidantes de alta temperatura. La adición de grandes cantidades de cromo y níquel a aleaciones de hierro mejora su resistencia a la oxidación y retarda los efectos de la oxidación catastrófica debida a algunos otros elementos.
9.6. LA CORROSIÓN EN LA ECONOMÍA MUNDIAL
IMPORTANCIA ECONÓMICA DE LA CORROSIÓN
Gracias a los estudios realizados, se ha llegado a la conclusión de que, aunque se tomen todas las previsiones posibles, no se puede impedir completamente las pérdidas de metales por corrosión, pero cabe lograr una disminución en la magnitud de los perjuicios, y esto basta para que todos los esfuerzos sean justificados. Queremos decir que en el dominio, realmente muy complejo, de la corrosión y la protección contra ella, deben ponerse en tensión todas las actividades, tanto en el campo de la investigación como en el de la enseñanza; el conocimiento de los fenómenos de corrosión y la puesta a punto de medidas eficaces contra ella es una exigencia económica mundial, como consecuencia del enorme consumo de los materiales metálicos.
Los primeros cálculos correctos de la magnitud de los daños causados por la corrosión datan, aproximadamente, de la segunda década de nuestro siglo. Sobre la base de una estadística cuidadosa el West Scotland Iron and Steel Institute (West Scotland Instituto del Hierro y del Acero), comprobó que por la formación de orín (Capa de color rojizo que se forma en la superficie del hierro y otros metales a causa de la humedad o del aire.) se habían destruido, entre los años 1890 y 1923, nada menos que 718 millones de toneladas de hierro, de los 1766 millones de toneladas que alcanzo la producción total. [1]
En las perdidas por corrosión hay que distinguir:
PERDIDAS INDIRECTAS, muy difíciles de evaluar. Hay que contar aquí con los efectos sobre la salud y la vida de los hombres, que pueden ser la consecuencia de explosiones y fugas en agregados industriales no estancos. Se incluyen en estas pérdidas las de material y dinero que no se refieren propiamente al material corroído, como son por ejemplo las de petróleos, gas natural o agua en conductos deteriorados, las de energía eléctrica, alimentos y agua potable, por el ataque corrosivo, estas últimas, de las paredes de los depósitos
También son perdidas indirectas los gastos excesivos que resultan de luchar contra el peligro de la corrosión incrementando las dimensiones de los aparatos industriales, por introducción de mayores coeficientes de seguridad, con el fin de que se conserve la resistencia mecánica cuando se presente la corrosión. Repetimos que estas pérdidas indirectas son muy difíciles de valorar. [1]
PERDIDAS DIRECTAS, que se refieren a los gastos resultantes de sustituir las instalaciones corridas y, además, todos los necesarios para mantener una protección permanente de cualquier tipo de instalaciones metálicas (corrosión sin control), así como los que resultan de la necesidad de sustituir el acero, considerado como material de construcción usual, por otros materiales, a fin de conseguir una cierta independencia respecto a la duración. Entran aquí los gastos que resultan de sustituir los aceros ordinarios por aceros aleados o por metales no férreos. En este aspecto también hay que tener en cuenta que los costos de montaje por kilogramo de material son más elevados que para el acero, como consecuencia de la diferencia de peso especifico. [1]
9.6 EJERCICIOS SOBRE CORROSION Y VIDEOS
Fundamentos de corrosión y protección.
1. ¿Que ventajas presenta desde el punto de vista de la corrosión en la protección del acero un recubrimiento de Zn (galvanizado) frente a un recubrimiento de Cr (cromado)
- El mayor espesor conseguido.
- El proceso electrolítico.
- Proporciona protección catódica.
- El acabado conseguido.
2.En la corrosión húmeda se corroen las zonas:
- Más cercanas al medio corrosivo.
- Más electropositivas.
- Más electronegativas.
- De transmisión.
3.La protección anódica en la corrosión se fundamenta en:
- La anulación del proceso corrosivo por aportación de fuente eléctrica.
- Limitación del proceso corrosivo por trabajar en zonas de pasivación.
- Constituir el material de sacrificio como ánodo del circuito
- La pasivación de las zonas catódicas del material.
4.La protección catódica en la corrosión se fundamenta en:
- La polarización catódica por medio de una fuente que suministra corriente eléctrica.
- La polarización del material que hace de cátodo por eliminación del electrolito.
- La pasivación de las zonas catódicas del material.
- La aplicación de películas orgánicas.
5.La protección catódica en la corrosión se fundamenta en:
- La anulación del proceso corrosivo por aportación de fuente eléctrica.
- Limitación del proceso corrosivo por trabajar en zonas de pasivación.
- Constituir el material de sacrificio como ánodo del circuito.
- La pasivación de las zonas catódicas del material.
6.La protección con películas metálicas está fundamentado en:
- Efecto barrera por metales más nobles.
- Efecto anódico por metales más nobles.
- Efecto catódico por los metales menos nobles.
- Efecto barrera por metales menos nobles.
7.Un acero se alea para:
- Mejorar su templabilidad.
- Mejorar su resistencia a la corrosión.
- Endurecer el acero por aleación.
- Todas son correctas.
8.Los metales con un E0 mayor que el del H2 se denominan:
- Anódicos.
- Activos.
- Catódicos.
- Ninguna es correcta.
9.En el cátodo se pueden generar:
- Deposiciones metálicas.
- Generación de H2.
- Reacción de reducción.
- Todas son correctas.
10. Los ánodos de sacrificio se utilizan para:
- Protección anódica.
- Protección catódica.
- Protección mediante pinturas.
- Protección por corriente impresa.
11.El efecto de área es típico de la :
- Corrosión por desgaste.
- Corrosión por picadura.
- Corrosión galvánica.
- Corrosión bajo tensión.
12.En el ánodo se puede generar:
- Reacción de oxidación.
- Electrones libres.
- Iones metálicos.
- Todas son correctas.
13.En el cátodo se pueden generar:
- Electrones libres.
- Deposiciones metálicas.
- La corrosión.
- Iones metálicos.
14.En el ánodo se puede generar:
- Reacción de oxidación.
- Reacción de reducción.
- Generación de H2.
- Deposiciones metálicas.
15.En el cátodo se pueden generar:
- Electrones libres.
- Iones metálicos.
- Reacción de reducción.
- Reacción de oxidación.
16.En el ánodo se puede generar:
- Generación de H2.
- Electrones libres.
- Reacción de reducción.
- Deposiciones metálicas.
17.El recubrimiento de zinc se fundamenta en:
- La protección por efecto barrera.
- La protección por ánodos de sacrificio.
- La transpasivación
- La protección por inhibidores.
18.El recubrimiento con estaño se fundamenta en:
- La protección por efecto barrera.
- La protección por ánodos de sacrificio.
- La transpasivación
- La protección por inhibidores.
19.Cuando la velocidad de ataque corrosivo al metal es debida al movimiento relativo de un fluido corrosivo, se denomina:
- Corrosión erosiva.
- Corrosión galvánica.
- Corrosión intergranular.
- Corrosión por cavitación.
20.Cuando la corrosión es causada por la formación e impulsión de burbujas de aire o vapor cerca de la superficie metálica, se denomina:
- Corrosión erosiva.
- Corrosión galvánica.
- Corrosión intergranular.
- Corrosión por cavitación.
21.El deterioro por corrosión localizada y/o adyacente a los límites de grano de una aleación se denomina:
- Corrosión erosiva.
- Corrosión galvánica.
- Corrosión intergranular.
- Corrosión por cavitación.
22.La corrosión caracterizada por una reacción química o electroquímica que actúa uniformemente sobre toda la superficie del metal expuesto se denomina:
- Corrosión intergranular.
- Corrosión por picaduras.
- Corrosión generalizada.
- Corrosión galvánica.
23.El ataque corrosivo localizado que produce pequeños hoyos en el metal se denomina:
- Corrosión intergranular.
- Corrosión por picaduras.
- Corrosión generalizada.
- Corrosión galvánica.
24.La descincificación de los latones se caracteriza como:
- Corrosión por hendiduras
- Corrosión intergranular.
- Corrosión por picaduras.
- Corrosión selectiva.
Problema 12.1 Un tanque cilíndrico de acero suave (bajo en carbono) de 1 m de altura y 50 cm de diámetro, contiene agua aireada hasta un nivel de 60 cm y muestra una pérdida de peso debido a la corrosión de 304 g al cabo de 6 semanas. Calcular: a) la corriente de corrosión; b) la densidad de corriente implicada en la corrosión del tanque. Supóngase que la corrosión es uniforme sobre la superficie interior del tanque y que el acero se corroe en la misma forma que el hierro puro.
Problema 12.2 Se desea diseñar un tanque para contener ácido clorhídrico diluido, y el material seleccionado para ello es un acero al carbono (F 1120), con una densidad de 7.81 g/cm3 , que tiene una velocidad de corrosión en ese medio de 45 mdd (mg por dm2 por día) . Estimar el sobrespesor con que debería diseñarse el depósito para asegurar al menos 10 años de vida.
Problema 12.3 Una superficie de cobre se corroe por agua de mar, con una densidad de corriente de 2,45 x 106 A/cm2 . Determinar: a) ¿Cual es la velocidad de corrosión en mdd? b) ¿Qué espesor de metal se corroe en seis meses? Considerar: El peso de un mol de cobre es de 63.4 g. La densidad del cobre es de 8.03 g/cm3 . La constante de Faraday es 96500 A · s/mol.
Solucion de las preguntas de seleccion multiple:
1 – a, 2 – c, 3 – b, 4 – a, 5 – c, 6 – a, 7 – d, 8 – c, 9 – d, 10 – b, 11 – c, 12 – d, 13 – b, 14 – a, 15 – c, 16 – b, 17 – b, 18 – a, 19 – a, 20 – d, 21 – c, 22 – c, 23 – b, 24 – d.
Solucion de los problemas planteados:
Problema 12.1
Problema 12.3
BIBLIOGRAFÍA
[1] corrosión, remando contra la corriente [en línea] argentina: ionis. [Consultado sábado 7 de julio de 2012] Disponible en: <http://www.ionis.com.ar/agua/corrosion.htm>
[2] Medidas de defensa contra la corrosión [en línea] [consultado sábado 10 de julio de 2015]Disponible en: <http://medidasdedefensacontralacorrosion.blogspot.com/2012/06/medidas-de-proteccion-contra-la.htmlcorrosión>
[3] RIERA, Roselby, Ciencia de los materiales, corrosión [en línea] [consultado sábado 7 de julio de 2012] Disponible en: < http://cma403.blogspot.com/2008/07/corrosin.html>
[4] corrosión galvánica, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://es.scribd.com/doc/94725432/Corrosion-Galvanica-y-Uniforme>
[5] DIAZ, Ángel Omar, corrosión macroscópica por fabricas de pintura [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://es.scribd.com/doc/57154049/7/Corrosion-macroscopica>
[6] la corrosión, falta de análisis y especialistas en materiales de selección: erosión- corrosión, [en línea] corrosión testing laboratorios, inc. [Consultado sábado 7 de julio] Disponible en: <http://www.corrosionlab.com/papers/erosion-corrosion/erosion-corrosion.htm>
[7] agrietamiento por corrosión, [en línea] cámaras climáticas. [Consultado sábado 7 de julio de 2012] Disponibles en: <http://cci-calidad.blogspot.com/2011/02/agrietamiento-por-corrosion.html>
[8] tipos de corrosión, [en línea] NERVION PINTURAS, [consultado sábado 7 de julio de 2012] disponible en: <http://www.nervion.com.mx/web/conocimientos/tipos_corrosion.php>
[9] tipos de corrosión, [en línea] [consultado sábado 7 de julio de 2012] disponible en: <http://www.textoscientificos.com/quimica/corrosion/tipos>
[10] tipos de corrosión, [en línea] [consultado sábado 7 de julio de 2012] disponible en: <http://www.textoscientificos.com/quimica/corrosion/tipos>
[11] corrosión intercristalina, [en línea] cámaras cristalinas. [Consultado sábado 7 de julio de 2012] disponible en: <http://cci-calidad.blogspot.com/2009/08/corrosion-intercristalina.html>
[12] corrosión intercristalina, [en línea] cámaras cristalinas. [Consultado sábado 7 de julio de 2012] disponible en: <http://cci-calidad.blogspot.com/2009/08/corrosion-intercristalina.html>
[13] Corrosión bajo tensión, [en línea] metal improvement company. [Consultado sábado 7 de julio de 2012] Disponible en: [http://spanish.metalimprovement.com/corrosion.php]
[14] daños por hidrogeno en la corrosión, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://www.buenastareas.com/ensayos/Da%C3%B1os-Por-Hidr%C3%B3geno-En-La-Corrosi%C3%B3n/468105.html
[16] celdas electroquímicas, [en línea] universidad central de Venezuela. [Consultado sábado 7 de julio de 2012] Disponible en: <http://www.ciens.ucv.ve/eqsol/Electroquimica/Clases/clases/P4.pdf>
[17] celdas electroquímicas, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <celdaselectroquimicas09.blogspot.com>
[18] celdas galvánicas o celdas voltaicas, [en línea] pontificia universidad católica del Perú. [Consultado sábado 7 de julio de 2012] Disponible en: <http://corinto.pucp.edu.pe/quimicageneral/contenido/42-celdas-galvanicas-o-celdas-voltaicas>
[19] potencial electrodo estándar a 25°C “respecto al potencial del hidrógeno”, Química 4M a las de la ciencia [En línea] Hastinik, S.A. [Consultado 7 de Julio de 2012] Disponible en: <http://quimica4m.blogspot.com/>
[20] Imagen pila seca en la cual se produce una fem de 1.5V, Química 4M a las de la ciencia [En línea] Hastinik, S.A. [Consultado 7 de Julio de 2012] Disponible en: <http://quimica4m.blogspot.com/>
[21] recubrimientos anticorrosivos, [en línea] México, NERVION PINTURAS. [Consultado sábado 7 de julio de 2012] Disponible en: <http://www.nervion.com.mx/web/Tecnologia/fundamen.htm>
[22] recubrimientos anticorrosivos, [en línea] México, NERVION PINTURAS. [Consultado sábado 7 de julio de 2012] Disponible en: <http://www.nervion.com.mx/web/Tecnologia/fundamen.htm>
[23] cromado electrolítico, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://www.cientificosaficionados.com/tecnicas/cromado%20electrolitico.htm>
[24] cromado electrolítico, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://apaladas.blogspot.com/2011/05/cromado-o-niquelado-de-piesas-de-auto.html>
[25] BARAJAS Arturo, tipos de recubrimientos, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://www.monografias.com/trabajos85/tipos-recubrimientos/tipos-recubrimientos.shtml#cromadoa>
[26] BIANCHI Benjamín, cobreado, [en línea] [consultado sábado 7 de julio de 2012] Disponible en: <http://www.monografias.com/trabajos33/cromado-electrolitico/cromado-electrolitico.shtml>
[27] como cobrear un objeto metálico, [en línea] [consultado sábado 7 de julio de 2012] Disponible en:< http://superciencia.com/2006/03/31/como-cobrizar-un-objeto-metalico/>
[28] galvanización y sistema dúplex, [en línea] porta conductores LTDA [consultado sábado 7 de julio de 2012] Disponible en: <http://portaconductoreschile.cl/category/galvanizado-en-caliente-para-acero/>
[29] galvanizado, [en línea] ASOMETAL [consultado sábado 7 de julio de 2012] Disponible en: <http://www.asometal.org/?p=165>
[30] VELASCO CORRAL C, recubrimientos metálicos, [en línea] enciclopedia GER [consultado sábado 7 de julio de 2012] Disponible en: <http://www.canalsocial.net/ger/ficha_GER.asp?id=11940&cat=tecnologia>
[31] extraído de la pagina web el 10 de julio del 2015 <https://educarenergetico.files.wordpress.com/2007/08/proteccion-contra-la-corrosion.pdf> que cuenta con la siguiente bibliografia:
- Chemical Education Material (CHEMS)
- Chang, Raymond: Química, México, McGraw-Hill, 1995.
- Dima, J.C.:Cubiertas Protectoras (Trabajo Práctico Nº 6), Cátedra de Química Aplicada, Facultad Regional Buenos Aires, Universidad Tecnológica Nacional, 1984.
- Español, Carlos E.: Química Inorgánica 43.04, Para la Carrera de Ingeniería Química (Guía de T.P.), UBA, Facultad de Ingeniería, 1980.
- Facultad de Ingeniería, UBA:Química General e Inorgánica 3.01, T.P. Nº 24 (parte III), Buenos Aires, 1973.
- Fernandez Serventi, Héctor: Química (Cuarto año de Escuelas de Educación Técnica), Buenos Aires, Losada, 1975.
- Whitten, Kennet W.; Gailey, Kennet, D.; Davis, Raymond E.:Química General; México, McGraw-Hill, 1992.
[32] Fritz, Todt. CORROSION Y PROTECCION. Editorial Aguilar. Madrid – España 1959
[33] José Ludey Marulanda Arévalo, FUNDAMENTOS DE LA COR ROSION. Universidad Tecnológica de Pereira 2006
[34] DONALD R. ASKELAND. y PRADEEP P. PHULÉ. Cuarta edición. Ciencia e ingeniería de los materiales, University of Missouri, University of Pittsburgh.
[35] WILLIAM F. SMITH. y JAVAD HASHEMI. Cuarta edición. Fundamentos de la ciencia e ingeniería de materiales. University of Central florida, Texas tech University.
[36] HAROLD PEREZ LOPEZ Y JORGE LUIS ZAMUDIO CORONEL, trabajo de grado 2009, evaluación de la protección contra la corrosión de algunos recubrimientos alquidicos expuestos a condiciones ambientales y a cámara de niebla salina, Universidad Tecnológica de Pereira.
[37] IMAGEN SACADA el 10 de julio del 2015 de http://images.slideplayer.es/8/2448646/slides/slide_33.jpg
[38] http://avibert.blogspot.com/2010/04/problemas-mas-frecuentes-en-el.html
[39] http://slideplayer.es/slide/154546/
——————————————————————————————-
- PRIMERA ACTUALIZACION
Recopilación y edición realizada por Sebastián Agudelo Sánchez Martinez Duque, Randy Gallego Garcia, Cristian Camilo Garcia Castaño, estudiantes de ingeniería mecánica de la universidad Tecnológica de Pereira 2012
- SEGUNDA ACTUALIZACION
Recopilación y edición realizada por Jorge Iván Cerón Pabón, Luis Gabriel Carmona, Jaime Córdoba y Daniel Jimenez estudiantes de ingeniería mecánica de la universidad Tecnológica de Pereira 2013
- TERCERA ACTUALIZACION
Recopilación y edición realizado por, Santiago Montoya Garcia, Katherine Osorio Arroyave. Estudiantes de ingeniería mecánica de la universidad Tecnológica de Pereira 2015.
- CUARTA ACTUALIZACION (CORROSION INTERSEMESTRAL 2015)
Recopilación y edición realizada por Juan David Henao Castrillon, Daniel Rios Osorio y Yeison Oswaldo Gomez C. estudiantes de ingeniería mecánica de la universidad Tecnológica de Pereira 2015