LISTADO DE FIGURAS
Figura 12.1. Pieza de un barco con corrosión. [11]
Figura 12.2. Representación esquemática del proceso de corrosión y el costo de cada etapa[6]
Figura 12.3. Interacción de la humedad en una pieza. [8]
Figura 12.4. Corrosión uniforme en una placa rectangular. [1]
Figura 12.5. Corrosión en placas [1]
Figura 12.6. Corrosión por picadura en una placa rectangular. [1]
Figura 12.7. Corrosión por cavitación. [13]
Figura 12.8. Corrosión microbiológica. [13]
Figura 12.9. Corrosión por intergranular en una placa rectangular. [1]
Figura 12.10. Corrosión por erosión.[13]
Figura 12.11. Estructura de la película formada por la oxidación.
Figura 12.12. Gráfica de aumento de peso por unidad de área frente al tiempo. [10]
Figura 12.13. Corrosión electroquímica. [10]
Figura 12.14..Corrosión galvánica. [3]
LISTADO DE VÍDEOS
Vídeo 12.1 Resumen y explicación de oxidación y corrosión. [15]
Vídeo 12.2 Definición y explicación de algunos tipos de corrosión. [16]
LISTADO DE TABLAS
Tabla 12.1. Potencial eléctrico de elementos. [8]
Tabla 12.2. Comparación entre la reacción anódica y la reacción catódica. [10]
12.1 INTRODUCCIÓN
A lo largo de este capítulo se hablará del fenómeno de corrosión, teniendo en cuenta cada uno de los procesos de corrosión y los factores que lo provocan. Además de mencionar cómo afecta la corrosión en la vida útil de estructuras que a diario observamos como puentes y edificios. De igual forma, mencionar los aspectos relacionados con la corrosión como la contaminación ambiental, pérdida de productos, mantenimientos muy costosos y la necesidad de re diseñar equipos y procesos industriales.
12.2 CORROSIÓN
La palabra “corroer” se deriva del latín “corrodere”, que significa “roer las piezas”. El fenómeno de corrosión guarda gran similitud frente dicha definición etimológica, por lo cual, se define al fenómeno de la corrosión como la transformación de un material debido a reacciones químicas o electro químicas con el medio que lo rodea, lo cual produce un deterioro del material y de sus propiedades. [1] [2]
La corrosión es también considerada una oxidación acelerada y continua que desgasta, es decir, que para que exista el fenómeno de corrosión tiene que haber un proceso de oxidación previo; dicho proceso ocurre cuando un átomo inestable pierde un electrón, lo que permite que el átomo forme un compuesto nuevo con otro elemento, es decir, el proceso se caracteriza por ceder electrones del elemento que se oxida al elemento oxidante [3]. Obsérvese en la figura 12.1 una pieza de un barco con corrosión.
Figura 12.1. Pieza de un barco con corrosión. [11]
No siempre que se presenta la oxidación de un metal existe corrosión, en algunos casos el óxido formado es resistente y forma una capa gruesa de óxido que impide que el resto del material continúa oxidándose [13]. Este fenómeno es común en materiales de aluminio, zinc y magnesio. [4]
Material + Oxígeno → Óxido de material ±Energía.
12.3 ¿POR QUÉ OCURRE EL PROCESO DE CORROSIÓN?
Para la obtención de los metales en estado puro, se debe recurrir a la separación de minerales a partir de yacimientos (rocas menas), lo cual supone un gran aporte energético. Pues bien, una vez producido el acero, éste prácticamente inicia el periodo de retorno a su estado natural, los óxidos de hierro (Fe2O3). Esta tendencia a su estado original no debe extrañar. La tendencia del hierro a volver a su estado natural de óxido metálico se relaciona directamente con la energía utilizada para extraer el metal del mineral, ya que es esta energía la que le permitirá el posterior regreso a su estado original a través de un proceso de oxidación (corrosión). La cantidad de energía requerida y almacenada varía de un metal a otro. Entonces, la fuerza conductora que causa que un metal se oxide es consecuencia de su existencia natural. [5]
Por ejemplo un metal susceptible a la corrosión, como el acero, resulta que proviene de óxidos metálicos, a los cuales se los somete a un tratamiento determinado para obtener precisamente hierro. Otro ejemplo es el aluminio, que obtenido en estado puro se oxida rápidamente, formándose sobre su superficie una capa microscópica de alúmina (Al2O3, óxido de aluminio); este óxido es transparente, a diferencia del óxido de hierro que es color rojizo o marrón, por lo cual pareciera que el aluminio nunca se oxida. La razón de ello estriba en el gran aporte energético que hay que realizar para obtener una determinada cantidad del metal a partir del mineral, bauxita (Al2O3) en este caso.[5]
12.4 EFECTOS DE LA CORROSIÓN
Los efectos de la corrosión en la sociedad se observa tanto de manera directa, afectando la vida útil de servicio de los bienes; y de manera indirecta, en el momento en que los productores y consumidores de los bienes tienen influencia sobre los costos de la corrosión. Estos efectos se evidencia diariamente en distintas áreas, por ejemplo es muy común observar que un automóvil, unas ventanas o herramientas metálicas sufran de este fenómeno. Sin embargo, los efectos de la corrosión son de extremo cuidado. Por ejemplo, en un puente puede ocurrir la corrosión de alguna varilla de acero de refuerzo del concreto, la que puede fracturarse y provocar el fallo o colapso de la estructura por completo; esto no solo afectaría a la sociedad sino también al medio ambiente. Ahora, supongamos el transporte de petróleo crudo a través de buques. Si no se tiene el adecuado mantenimiento del buque, se puede producir una rotura en su casco y el petróleo sería derramado al mar, causando una daño muy grande al ecosistema marino. [2]
Entonces, se tiene que hacer un análisis continuo y aplicar los distintos factores que permitan evitar este tipo de situaciones que pueden llegar a ser peligrosas para la sociedad y medio ambiente.
12.4.1 Fenómeno de la corrosión y costos del proceso: por supuesto, todos los efectos sociales tienen que ver con la economía. Es por eso que hay muchas razones de buscar alternativas para controlar la corrosión. [6]
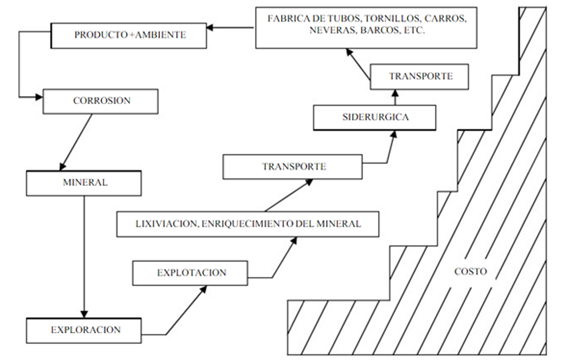
La corrosión causa pérdidas enormes y desgracias incalculables, debidas a accidentes producidos por la rotura de piezas debilitadas. Esto ocasiona que la corrosión sea responsable de que de 1/4 a 1/3 de la producción mundial de acero se dedique a la reposición de las estructuras metálicas deterioradas [7][14]. Esto es un desarrollo cuyo proceso arranca desde la creación del producto, es decir, en la explotación de los yacimientos para la extracción de los minerales presentes hasta el mantenimiento de la pieza, una vez construida. Las etapas de este desarrollo y la energía utilizada generan costos específicos que pueden ser elevados, por lo cual, no cabe la menor duda de que ningún proyecto quisiera perder dicha inversión. He aquí, la importancia del mantenimiento continuo de los materiales.
A continuación, se observa el ciclo natural al que tiende un material y el costo involucrado en las operaciones de exploración, explotación y enriquecimiento del material mineral, así como las etapas de producción de los respectivos metales y de los productos manufacturados a partir de ellos. Obsérvese la figura 12.2.
Figura 12.2. Representación esquemática del proceso de corrosión y el costo de cada etapa. [6]
A través de avances científicos en distintas ramas incluyendo a la termodinámica, se ha logrado determinar el posible comportamiento de un metal en un ambiente dado. En las predicciones que aporta la termodinámica, se han planteado algunas bases teórico-prácticas a partir del concepto energético: sí el sistema formado por el metal y el medio ambiente posee una energía libre positiva, es posible que tenga lugar la corrosión. La energía de un determinado sistema puede medirse en los términos de lo que se llama la energía libre [5].
Se pueden presentar tres casos:
- La energía libre es positiva. El metal es activo y puede haber corrosión. Es el caso más frecuente entre los metales de uso común (hierro, aluminio, cinc).
- La energía libre es positiva, pero el metal en vez de presentar corrosión, permanece aparentemente intacto; se dice que el metal es pasivo.
- La energía libre es cero o negativa. El metal es indiferente a los agentes agresivos habituales, no siendo posible ninguna reacción de corrosión. Es el caso de los metales nobles.
12.5 FACTORES INFLUYEN EN LA CORROSIÓN
Los siguientes factores son los que generalmente se consideran en el proceso de oxidación que conlleva a la corrosión:
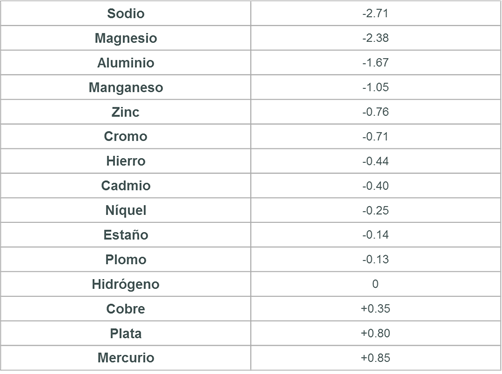
12.5.1 Potencial eléctrico de los materiales: el grado de corrosión depende fundamentalmente de la diferencia de potencial eléctrico existente entre los dos metales en contacto. Cuanto más bajo sea el potencial de un metal, más fácil resultará corroído. Del mismo modo cuando mayor sea la diferencia de potencial entre los dos metales en contacto, mayor será la corrosión galvánica producida entre ambos, siempre en perjuicio del de menor potencial. [8] [9]
En la tabla 12.1 se observan algunos elementos con sus respectivos potenciales.
Tabla 12.1. Potencial eléctrico de elementos. [8]
12.5.2 Formación de películas y biopelículas: las películas formadas por microorganismos (Biofilm) pueden tener tendencia a absorber la humedad o retenerla, incrementando la corrosión resultante de la exposición a la atmosférica o los vapores corrosivos.[8]
12.5.3 Temperatura: es un aspecto que afecta directamente a la corrosión, ya que ésta tiende a aumentar al elevar la temperatura. Esto se debe a que se afecta la solubilidad de la sustancia más común que interviene en la corrosión, el aire. Con respecto a la disminución de temperatura en lugares húmedos, la humedad se condensa y se aloja en la superficie de los materiales acelerando la corrosión. Cuando el porcentaje de humedad en el ambiente es mayor a 80% la reacción aumenta y se acelera la corrosión, en el caso que se encuentre por debajo del 40% la velocidad de la reacción disminuye. [9]
12.5.4 Velocidad: un aumento en la velocidad del movimiento relativo entre una solución corrosiva y una superficie metálica tiende a acelerar la corrosión, ocasionando que las sustancias oxidantes lleguen a la superficie. Todos los metales pueden ser usados siempre que su velocidad de deterioro sea aceptablemente baja, ya que influye en el costo-beneficio de algún proyecto y el bienestar de la sociedad frente a éste. [8]
12.5.5 Agentes oxidantes: los agentes oxidantes que aceleran la corrosión de algunos materiales pueden retrasar la corrosión de otras, mediante la formación en sus superficies de óxidos o capas de oxígeno absorbidos que los hacen más resistentes a los ataques químicos. El ambiente influye directamente en el proceso, así es como dependiendo del pH del ambiente se obtiene una corrosión más rápida y certera. Por ejemplo al exponer un metal a un medio que es corrosivo con contaminantes como es el caso del azufre, la reacción ocurre mucho más rápido que en medios normales. Por lo general, las piezas se ven afectadas por agentes como: el aire y humedad, agua, agua salada, vapor (H2O a una temperatura entre 200 a 400 ºC), distintos gases como los CFC, NH3, ácidos orgánicos. [8] [9]
12.5.6 Propiedades físicas y tratamientos del material: cuando el material ha sido sometido a esfuerzos cíclicos de torsión, flexión, compresión o la combinación de estos, es más susceptible a la corrosión. Sí la estructura externa del material posee poros o grietas, es más susceptible a la corrosión. [9]
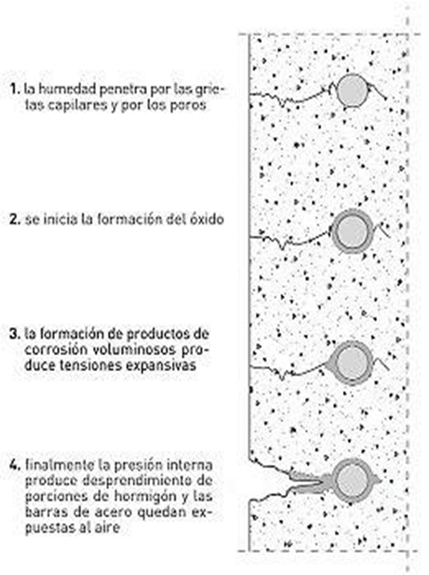
En la figura 12.3 se observa cómo se genera el proceso debido a las propiedades físicas del material y a los agentes oxidantes, en este caso, la humedad y el aire.
Figura 12.3. Interacción de la humedad en una pieza. [8]
A continuación se presenta un vídeo, (vídeo 12.1) el cual explica lo anterior y muestra una serie de ejemplos en la industria metal-mecánica.
Vídeo 12.1 Resumen y explicación de oxidación y corrosión. [15]
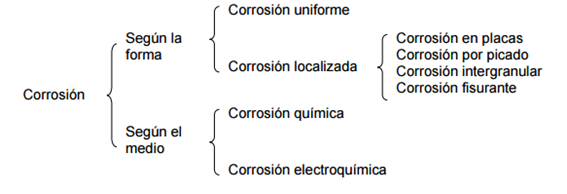
12.6 CLASIFICACIÓN DE LOS PROCESOS DE CORROSIÓN
La corrosión se puede clasificar según su morfología o según el medio en que se desarrolla:[1]
12.6.1 CORROSIÓN SEGÚN LA FORMA:
12.6.1.1 Corrosión uniforme: en este tipo de corrosión se presenta el ataque en forma homogénea sobre toda la superficie metálica y la penetración media es igual en todos los puntos. Esta es la forma más tratable de corrosión, ya que permite calcular fácilmente la vida útil de los materiales corroídos [1]. Obsérvese la figura 12.4 un ejemplo de corrosión uniforme.
Figura 12.4. Corrosión uniforme en una placa rectangular. [1]
12.6.1.2 Corrosión en placas: este tipo incluye los casos intermedios entre corrosión localizada y corrosión uniforme. Se caracteriza porque el ataque se extiende más en algunas zonas, pero se presenta aún como un ataque general [1]. Obsérvese la figura 12.5 un ejemplo de corrosión en forma de placas.
Figura 12.5. Corrosión en placas. [1]
12.6.1.3 Corrosión por picadura (Pitting): se genera debido a pequeños poros en la capa superficial de la pieza, por eso, el ataque se localiza en puntos aislados de superficies metálicas, propagándose hacia el interior del metal en forma de canales cilíndricos. Este tipo de ataque, así como el intergranular y el fisurante, son las formas más peligrosas bajo las cuales se puede presentar la corrosión [1][13]. Obsérvese la figura 12.6 un ejemplo de corrosión pitting.
Figura 12.6. Corrosión por picadura en una placa rectangular. [1]
El tipo de corrosión pitting presenta algunos derivados:
12.6.1.3.1 Corrosión por fricción o frettin: producida por pequeños movimientos o vibraciones de dos sustancias metálicas en contacto, generando picaduras en la superficie del metal.[12]
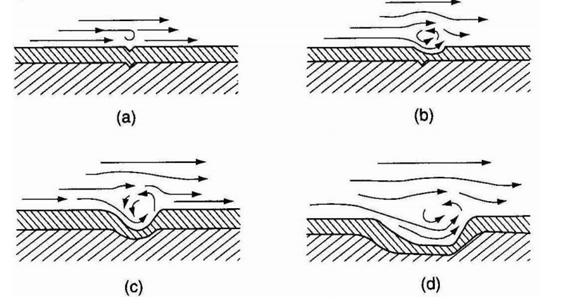
12.6.1.3.2 Corrosión por cavitación: se genera por el contacto de la superficie del metal con algún líquido, formando burbujas en su superficie. Es un fenómeno semejante al que le ocurre a las caras posteriores de las hélices de los barcos, dando lugar a picaduras en forma de panal [13]. Obsérvese la figura 12.7 un ejemplo de daño por cavitación.
Figura 12.7. Corrosión por cavitación. [13]
12.6.1.3.3 Corrosión microbiológica: en ella organismos biológicos originan la grieta o proceden como aceleradores del proceso corrosivo localizado. Ésta se produce normalmente en medios acuosos en donde los metales están sumergidos o flotando [12]. Obsérvese la figura 12.8 un ejemplo de corrosión microbiológica.
Figura 12.8. Corrosión por microbiológica. [13]
12.6.1.3.4 Corrosión intergranular: localizada en los límites del grano, causando pérdidas en la resistencia que desintegran los bordes de los granos, aunque por el aspecto externo de los materiales no se observe la corrosión. Este ataque es común en aceros inoxidables y aleaciones de níquel [12][13]. Obsérvese la figura 12.9 un ejemplo de corrosión intergranular en una placa.
Figura 12.9. Corrosión intergranular en una placa rectangular. [1]
12.6.1.3.5 Corrosión por erosión: causada o acelerada por el movimiento relativo de la superficie de metal y el medio. Se caracteriza por fricción en la superficie paralela al movimiento. Es muy significativa en aleaciones blandas [12][13]. Obsérvese en la figura 12.10 un ejemplo del proceso de corrosión por erosión.
Figura 12.10. Corrosión por erosión.[13]
12.6.1.3.6 Corrosión selectiva: actúa únicamente sobre metales nobles como oro-cobre o plata-cobre. Es peligroso ya que la corrosión del metal involucrado genera una película que recubre las picaduras y hace parecer al metal corroído como si no lo estuviera.[12]
12.6.1.3.7 Corrosión por esfuerzo: este tipo de corrosión es debida a la aparición de tensiones internas tras una deformación en frío. [12]
12.6.2 PROCESOS DE CORROSIÓN SEGÚN EL MEDIO
Los procesos de corrosión según el medio se dividen en corrosión química y corrosión electroquímica.
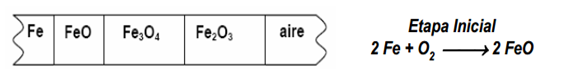
12.6.2.1 Corrosión química: en este tipo de corrosión se estudian aquellos casos en que el metal reacciona con un medio no -iónico (por ejemplo oxidación de un metal en aire a altas temperaturas). Sí se expone una superficie metálica limpia a la acción del oxígeno, el metal comenzará a reaccionar con el oxígeno formando óxidos.
Por ejemplo una pieza de Fe (metal que presenta más de una valencia) calentada al aire seco, por encima de 500ºC se oxida a apreciable velocidad formando una película con la siguiente estructura (obsérvese la figura 12.11):
Figura 12.11. Estructura de la película formada por la oxidación.
Se han producido reacciones redox sin la intervención de iones en solución y no ha habido corrientes eléctricas recorriendo el metal. [10] [12]
Si el grado de corrosión se expresa como aumento de peso por unidad de área, se observa que la corrosión se propaga en forma lineal con el tiempo, como se observa en la figura 12.12.
Figura 12.12. Gráfica de aumento de peso por unidad de área frente al tiempo. [10]
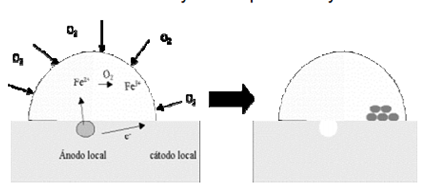
12.6.2.2 Corrosión electroquímica: a temperatura ambiente la forma de corrosión más frecuente y más seria es de índole electroquímica, este tipo de corrosión implica un transporte de electricidad a través de un electrolito. En los procesos de corrosión electroquímica circulan corrientes eléctricas, sobre el material expuesto a corrosión. A través de los avances en la ciencia se ha demostrado que durante la corrosión se cumplen las leyes de Faraday [12]. Estas corrientes se producen porque el material presenta zonas con diferente reactividad (centros anódicos y catódicos); existe un paso conductor que conecta las zonas anódica y catódica (el metal conduce los electrones) y ambos micro electrodos están inmersos en un mismo electrolito. [1] [10]
En la figura 12.13 se enseña el proceso de corrosión electroquímica.
Figura 12.13. Corrosion electroquimica. [10]
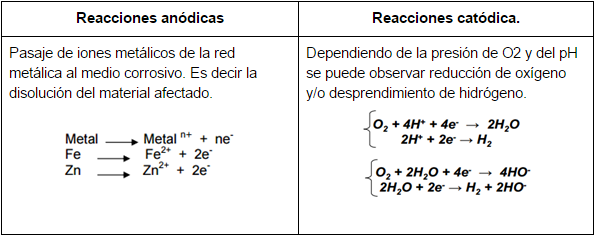
12.6.2.2.1 Reacciones en la corrosión electroquímica: se observa en la tabla 12.2 una comparación entre las reacciones que ocurren en una corrosión electroquímica.
Tabla 12.2. Comparación entre la reacción anódica y la reacción catódica. [10]
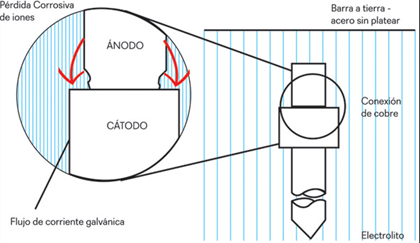
12.6.2.2.2 Corrosión galvánica: se da cuando dos metales diferentes están en contacto, uno activo y el otro noble; por un medio electrolítico hay flujo de electrones entre ellos. El metal menos resistente a la corrosión pasa a ser ánodo mientras el más resistente se vuelve cátodo. En este caso el cátodo se corroe muy poco, pero el ánodo aumenta su corrosión, comparado con los metales aislados entre sí. La velocidad de corrosión es proporcional al área de contacto. [9]
Obsérvese en la figura 12.14, el fenómeno de la corrosión galvánica.
Figura 12.14. Corrosión galvánica. [3]
A continuación se mostrará un vídeo (vídeo 12.2) con explicación esquematizada de algunos tipos de corrosión.
Vídeo 12.2 Definición y explicación de algunos tipos de corrosión. [16]
BIBLIOGRAFÍA
[1] http://materias.fi.uba.ar/6303/TPN3.pdf
[2] http://www.uv.mx/cienciahombre/revistae/vol20num2/articulos/corrosion/
[3]http://www.edu.xunta.es/centros/iescamposanalberto/aulavirtual/file.php/117/Tema2_Oxidacion.pdf
[4]http://prepa8.unam.mx/academia/colegios/quimica/infocab/unidad124.html
[5]http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/09/htm/sec_7.html
[6] http://es.scribd.com/doc/126891708/Libro-Corrosion-Respaldo#scribd
[7]http://www.eduinnova.es/monografias09/Nov09/Corrosion.pdf
[8]https://miutj.files.wordpress.com/…/ing_mi_factores-para-corrosion.ppt
[9] http://catarina.udlap.mx/u_dl_a/tales/documentos/lpro/peralta_r_e/capitulo3.pdf
[10] http://www.ing.unlp.edu.ar/quimica/Clase%20N12.pdf
[11] http://www.nervion.com.mx/web/conocimientos/anticorrosivos.php
[12]http://www.tecnosefarad.com/wp-content/archivos/bach_2/materiales/T4_la_corrosion.pdf
[13] http://biblio3.url.edu.gt/Libros/2013/cmI/6-Oxidacion.pdf
[14] http://www.bdigital.unal.edu.co/3053/1/291434.2010.pdf
[15] https://www.youtube.com/watch?v=bmIlSKbDnIw
[16] https://www.youtube.com/watch?v=aaejqLWrkcM
Recopilación realizada por:
Juan Camilo Zapata Mina
Luis Enrique Mina Vasquez
Miguel Angel Zapata Beltran
Manuel Alejandro Rojas Diaz