CONTENIDO
4.2 Diagrama de equilibrio.
4.2.1. Tipos de Reacciones Invariantes.
4.3 Clasificación simplificada de los diagramas de fases en metales.
4.4 Solidificación de los metales.
4.5 Solidificación monofásica de aleaciones o mezclas.
4.6 Diagramas, regla de la palanca y ley de fases de Gibbs.
4.6.3. Diagrama Hierro Carbono.
4.6.5. Regla de fases de Gibbs.
4.9.1. Nota Histórica: Hierro y Acero.
4.9.2.Clasificación y definición de aceros y fundiciones.
Tabla de contenido (figuras):
•Figura 1. Micro-estructuras.
•Figura 2. Solución sólida.
•Figura 3. Diagrama límite de soludibilidad.
•Figura 4. Diagrama de fase del agua.
•Figura5. Diagramade Fase binario Cu-Ni.
•Figura 6. Diagrama de fase binario Ag-Cu.
•Figura 7. Reacciones invariantes.
•Figura 8. Diagrama de solubilidad total.
•Figura 9. Diagrama solubilidad parcial.
•Figura 10. Proceso de solidificación.
•Figura 11. Curva de solidificación.
•Figura 12. Crecimiento planar.
•Figura 13. Diagrama Cu-Ni.
•Figura 14. Diagrama Pb-Sn.
•Figura 15. Solidificacion. •Figura 16. Reacción eutéctica en diagrama Pb-Sn •Figura 17. Diagrama Hierro-Carbono •Figura 18. Puntos críticos en diagrama Fe-C •Figura 19. Diagrama general para la aplicación de la regla de la palanca •Figura 20. Diagrama de equilibrio de fases para el agua pura. •Figura 21. Hombre y proceso de fundición.
Tabla de contenido (videos anexos).
- Video 1. Ejemplo diagrama Hierro-Carbono.
- Video 2. Regla de la palanca en diagrama Hierro-Molibdeno.
4.1 Introducción
Un diagrama de equilibrio es la representación gráfica de la temperatura en función de la composición química (normalmente en% en peso) de una aleación binaria. De manera práctica indica qué fases predominan en cada una de las temperaturas en función de la composición. Da mucha información de la microestructura de una aleación cuando se enfría lentamente (en equilibrio) a temperatura ambiente. Además, en un diagrama de fase se pueden observar los cambios que se producen en la microestructura y en las fases cuando varía la temperatura. Hay que recordar de nuevo que la microestructura final afecta notablemente las propiedades mecánicas. Los diagramas de fase son representaciones gráficas de las fases que existen en un sistema de materiales a varias temperaturas, presiones y composiciones. Los diagramas, en su mayoría, se han construido en condiciones de equilibrio (Los diagramas de equilibrio de fases se determinan mediante la aplicación de condiciones de enfriamiento lento), y son utilizados por ingenieros y científicos para entender y predecir muchos aspectos del comportamiento de los materiales.
La calificación de metales y aleaciones es uno de los procesos que más identifica a la Metalurgia. Los procesos de solidificación implican el conocimiento y control de las variables involucradas (por ejemplo, temperatura, composición, Velocidad de flujo, etc.) en el procesamiento de los materiales metálicos para obtener la estructura, la composición y la forma deseada de ellas.
Diagrama de Fases
Son representaciones gráficas de las fases que están presentes en un sistema de materiales a varias temperaturas, presiones y composiciones. La mayoría de los diagramas de fase han sido construidos según condiciones de equilibrio (condiciones de enfriamiento lento), siendo utilizadas por ingenieros y científicos para entender y predecir muchos aspectos del comportamiento de los materiales. Los diagramas de fases más comunes involucran temperatura versus composición.
Micro-estructura: las propiedades mecánicas y físicas de un material dependen de su micro-estructura. Esta puede consistir en una “simple” estructura de granos iguales en un metal o cerámica pura, o en una mezcla más compleja de distintas fases. Un ejemplo de micro-estructura puede ser: ferrita y perlita.
Fase: tres (3) características: 1) una fase tiene una misma estructura o arreglo atómico en todo el material; 2) una fase tiene aproximadamente una misma composición y propiedades; 3) hay una interface definida entre una fase y cualquier otra que la rodea o que sea su vecina.
Ejemplo: un bloque de hielo en una cámara de vacío, en estas condiciones, se tendrán en coexistencia tres fases: H2O líquido, H2O sólido Y H2O gaseoso, cada una siendo una fase diferente, con arreglos atómicos únicos, propiedades únicas y límites definidos entre ellas.
Componente: se refiere al tipo de material que puede distinguirse de otro por su naturaleza de sustancia química diferente. Por ejemplo, una solución es un sistema homogéneo (una sola fase) pero sin embargo está constituida por al menos dos componentes. Un ejemplo muy sencillo: Mezcla agua hielo 0°C: Tienen un componente: Agua y dos fases: solido y liquido.
Solución Sólida: Mezcla de átomos de dos tipos diferentes: uno mayoritario, que es el disolvente y otro minoritario, que es el soluto. Los átomos del soluto ocupan posiciones sustitucionales o intersticiales en la red del disolvente y se mantiene la estructura cristalina del disolvente puro.
Un ejemplo seria:
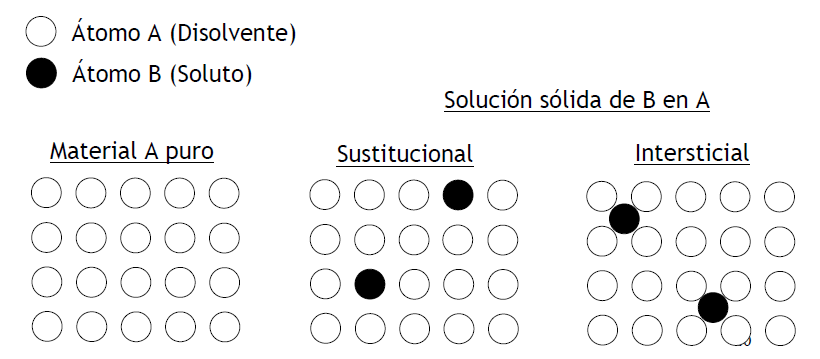
FIGURA 2. Solución Sólida.
Límite de Solubilidad: en muchas aleaciones y para una temperatura específica, existe una concentración máxima de átomos de soluto. La adición de un exceso de soluto a este límite de solubilidad forma otra disolución sólida o compuesto con una composición totalmente diferente.
Ejemplo: Agua +Azúcar
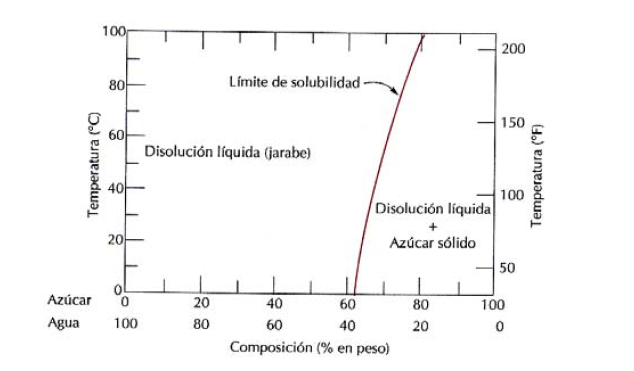
Figura 3. Diagrama de límite de solubilidad.
Diagramas de Fase de Equilibrio: los diagramas de equilibrio de fase son mapas (por ejemplo, en el espacio temperatura-presión o temperatura-composición) de las fases estables de un material en función de las condiciones de P, T y composición.
Ejemplo diagrama de fase (Agua).
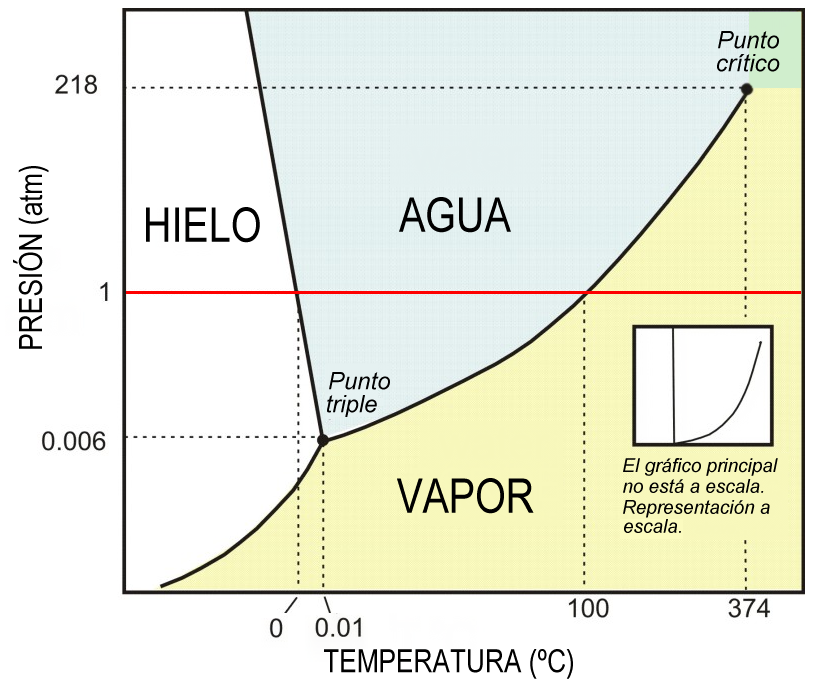
Figura 4. Diagrama de fase del H2O.
Diagrama de Fase Binarios: forma del diagrama de fases en el cual solo hay dos componentes. Su mayor aplicabilidad es en las áreas de la metalurgia, química y física. Como ejemplo se -tiene el diagrama Cu-Ni y el diagrama Ag-Cu:
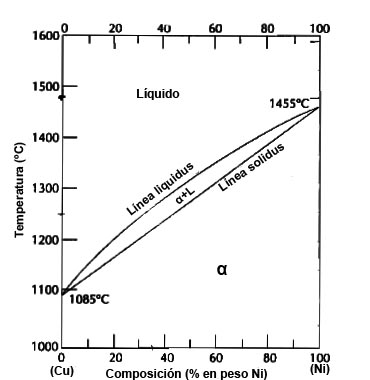
Figura 5. Diagrama de Fase binario Cu-Ni.
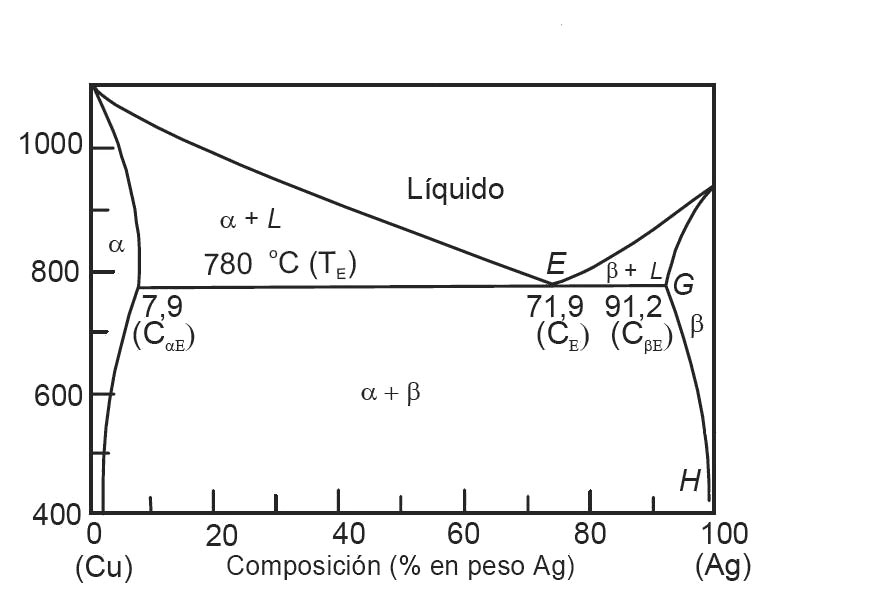
Figura 6. Diagrama de fase binario Ag-Cu.
Cuando aparecen varias sustancias, la representación de los cambios de fase puede ser más compleja. Un caso particular -el más sencillo-, corresponde a los diagramas de fase binarios. Ahora las variables a tener en cuenta son la temperatura y la concentración, normalmente en masa. En un diagrama binario pueden aparecer las siguientes regiones:
• Sólido puro o disolución sólida.
• Mezcla de disoluciones sólidas (eutéctica, eutectoide, peritéctica, peritectoide).
• Mezcla Sólido – Líquido.
• Únicamente líquido, ya sea mezcla de líquidos inmiscibles (emulsión) o sea un líquido completamente homogéneo.
• Mezcla líquido – gas.
• Gas (lo consideraremos siempre homogéneo, trabajando con pocas variaciones de altitud).
Hay puntos y líneas en estos diagramas importantes para su caracterización:
• Línea de líquidus, por encima de la cual solo existen fases líquidas.
• Línea de sólidus, por debajo de la cual solo existen fases sólidas.
• Línea eutéctica y eutectoide. Son líneas horizontales (isotermas) en las que tienen lugar transformaciones eutécticas y eutectoides, respectivamente.
• Línea de solvus, que indica las temperaturas para las cuales una disolución sólida (α) de A y B deja de ser soluble para transformarse en (α)+ sustancia pura (A ó B).
4.2.1. Tipos de Reacciones Invariantes:

Figura 7. Reacciones invariantes.
Definición de otros tipos de reacciones:
• Punto de fusión congruente: Un compuesto sólido al ser calentado mantiene su composición hasta el punto de fusión.
• Punto de fusión incongruente: Un compuesto sólido al ser calentado sufre reacciones peritécticas en un liquido y en una fase solida.
4.3 Clasificación simplificada de los diagramas de fases en metales.
Solubilidad total en estado sólido
Presentan únicamente líneas de líquidus y sólidus, forman soluciones sólidas substitucionales

Figura 8. Diagrama de solubilidad total.
Este diagrama presenta tres zonas diferentes:
Dos regiones monofásicas
• L (Liquido): Única fase liquida (A Y B son totalmente solubles).
• α: Única fase sólida: Solución sólida con una estructura cristalina definida (A y B son completamente solubles).
Región bifásica: Coexistencia de dos fases: líquida +sólida. (L + α).
Solubilidad parcial
En el sistema binario de solubilidad parcial habrá solubilidad total hasta un determinado porcentaje de cada elemento (límite de solubilidad), y luego de este límite habrá un estado de insolubilidad.
Dejando aparte el caso en la región donde coexisten líquido y sólido (caso anterior) en estos gráficos, en la región del sólido se puede determinar el porcentaje (%) de β y de α usando la regla de la palanca. Así mismo se puede determinar también la composición química de estas dos fases (no indicada en los gráficos) que van variando debido a la presencia de la curva solvus. En forma aproximada se puede determinar también el porcentaje de los constituyentes: en el caso de la figura de la derecha estos son 1) solución sólida β y 2) eutéctico (formado por α+β).

Figura 9. Diagrama de solubilidad parcial.
4.4 Solidificación de los metales.
Cuando un metal puro en estado líquido sometido a un proceso de enfriamiento alcanza su temperatura de solidificación, se inicia un proceso de formación de embriones o núcleos sobre los que van agregándose átomos, conformando así la estructura cristalina.
La solidificación de los metales y aleaciones es un importante proceso industrial, dado que la mayoría de los metales se funden para modelarlos como productos semiacabados o acabados.
1. Proceso de Solidificación
En general, la solidificación de un metal o aleación puede dividirse en las siguientes etapas.
1. La formación de núcleos estables en el fundido (nucleación).
2. El crecimiento de núcleos para formar cristales y la formación de una estructura granular.
La ilustración muestra las diversas etapas de solidificación de los metales:
a) Formación de núcleos.
b) Crecimiento de los núcleos hasta formar metales y
c) Unión de cristales para formar granos y límite de granos asociados.

Figura 10. Proceso general de solidificación.
2. Solidificación de Metales Puros
Cuando un metal puro solidifica bajo condiciones cercanas al equilibrio, toda la masa se cristaliza a una misma temperatura, conocida como temperatura de solidificación, Tf, que es constante y que se mantiene constante mientras se libera todo el calor latente de transformación; una vez que el metal ha solidificado ocurre el enfriamiento. Sin embargo, cuando el metal puro considerado anteriormente se solidifica bajo condiciones de no equilibrio, los cristales sólidos no se forman a la temperatura de solidificación, sino que ocurre a una temperatura T menor que Tf, lo que implica el requerimiento de un subenfriamiento cinético.
ΔTk = (Tf – T) definido e ilustrado mediante una curva de enfriamiento en la siguiente figura:

Figura 11. Curva de enfriamiento.
Se observa que, luego del subenfriamiento representado por el material, sufre un leve aumento de temperatura hasta llegar a la temperatura de fusión. Esto ocurre ya que, cuando existe suficiente sólido formado, éste libera una cantidad apreciable de calor latente de transformación, lo que eleva la temperatura del material hasta. Una vez alcanzada, la temperatura permanece constante durante la solidificación. El fenómeno de aumento de temperatura después del subenfriamiento recibe el nombre de recalescencia.
Los granos de un metal idealmente puro crecen en forma columnar plana –es decir, como un grano alargado- en las zonas inmediatamente aledañas a las paredes de los moldes, en la dirección principal de la transferencia de calor. En las zonas centrales, donde la formación de sólido metálico en las paredes disminuye la conductividad del calor, los granos suelen ser equiaxiales, como se muestra en la figura 12.
Figura 12. Crecimiento planar.
Tanto la solidificación como la fusión son transformaciones entre los estados cristalográficos y no cristalográficos de un metal o aleación; estas transformaciones, por supuesto, constituyen el fundamento de las aplicaciones tecnológicas al vaciado de lingotes, al vaciado de piezas, a la colada continua de metales y aleaciones, al crecimiento mono-cristalino de semiconductores, al crecimiento unidireccional de aleaciones mixtas (composite alloys), y a los procesos de soldadura.
Para que ocurra la solidificación del metal, sólo es necesario disipar el calor latente de solidificación, ΔH, que se puede lograr mediante las siguientes formas:
a) Por conducción desde el sólido, hacia un sumidero de calor.
b) Por conducción hacia el líquido, cuando está subenfriado a una temperatura inferior a Tf
c) Por aplicación de una fuerza electromotriz, o diferencia de potencial al existir un gradiente de temperatura (Efecto Peltier) cuando la corriente fluye a través de la intercara sólido-líquido en dirección hacia el líquido.
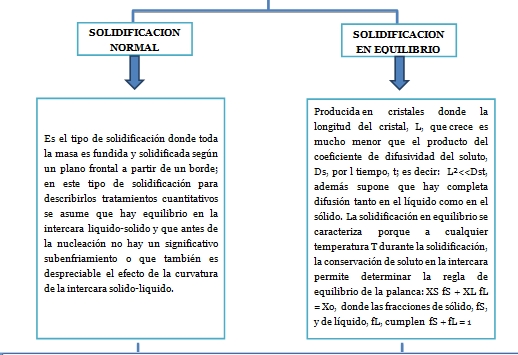
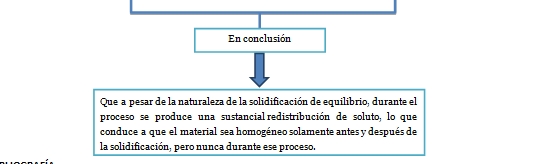
4.5 Solidificación monofásica de aleaciones o mezclas.
4.6 Diagramas, regla de la palanca y ley de fases de Gibbs.
Para llegar al diagrama de cobre níquel, es importante recordar qué es un diagrama de Equilibrio.
Los diagramas de equilibrio son gráficas que representan las fases y estado en que pueden estar diferentes concentraciones de materiales que forman diagramas que se componen de aleaciones, estas aleaciones son una mezcla sólida homogénea, de uno o más metales con algunos elementos no metálicos que pueden darse a diferentes temperaturas.
Dichas temperaturas van desde la temperatura por encima de la cual un material está en fase liquida hasta la temperatura ambiente y en que generalmente los materiales están en estado sólido.
Los elementos como el cobre y níquel tienen solubilidad total tanto en estado líquido como sólido.
Aplicaciones
• Utilizados en tuberías o como conductores (calor y electricidad)
• bujes, entre otras aplicaciones.
• Adicional a esto Las aleaciones de base cobre con níquel, ampliamente usadas en la operación de plantas y equipos en ambientes marinos, constituyen las aleaciones más adecuadas para la fabricación de piezas expuestas a la acción agresiva de los iones cloruros presentes en el agua de mar.

Figura 13. Diagrama Cobre-Níquel.
En el diagrama de la figura 13 se muestra el diagrama de fases de este sistema en el que se representa la composición química de la aleación en tanto por ciento en peso (en abscisas) y la temperatura en °C (en ordenadas). Este diagrama se ha determinado bajo condiciones de enfriamiento lento y a presión atmosférica y no tienen aplicación para aleaciones que sufren un proceso de enfriamiento rápido. El área sobre la línea superior del diagrama, línea de líquidus, corresponde a la región en la que la aleación se mantiene en fase líquida. El área por debajo de la línea inferior, línea sólidus, representa la región de estabilidad para la fase sólida. Entre ambas líneas se representa una región bifásica en la que coexisten las fases líquida y sólida. La cantidad de cada fase presente depende de la temperatura y la composición química de la aleación.
Para una determinada temperatura puede obtenerse aleaciones totalmente en fase sólida, en fase (sólida + líquida) y en fase totalmente líquida según la proporción de sus componentes. De la misma manera, para una determinada proporción de la mezcla, se puede definir una temperatura por debajo de la cual toda la aleación se encuentre en fase sólida, un intervalo de temperaturas en donde la aleación se encuentre en dos fases (sólida y líquida) y una temperatura a partir de la cual toda la aleación esté líquida.
El diagrama bifásico del sistema cobre-níquel quizás es el de más fácil comprensión e interpretación. Como anteriormente habíamos nombrado los ejes, el de las ordenadas que representa la temperatura, y en el de abscisas la composición en peso (abajo). La composición varía desde el 0% en peso de Ni (100% de Cu) en el extremo izquierdo horizontal hasta el 100% en peso de Ni (0% de Cu) en el derecho.
La zona líquido L es una disolución líquida homogénea compuesta por cobre y níquel. La fase α es una disolución sólida sustitucional, de átomos de cobre y de níquel, de estructura cristalina FCC. A temperaturas inferiores a 1080ºC el cobre y el níquel son mutuamente solubles en estado sólido en cualquier composición.
Esto se puede explica porque Cu y Ni tienen la misma estructura cristalina (FCC), radios atómicos y electronegatividades casi idénticos y valencias muy similares, lo podemos observar en la tabla periódica. Otro concepto importante para tener en cuenta es que el sistema cobre-níquel se denomina isomorfo debido a las solubilidades totales de los dos componentes en estados sólido y líquido.
El cobre permanecerá sólido hasta llegar a la temperatura de fusión. La transformación sólido a líquido tiene lugar a la temperatura de fusión, que permanece constante hasta que termina la transformación.
Reiterando lo anterior para otra composición distinta de la de los componentes puros, ocurre el fenómeno de la fusión en un tramo de temperaturas comprendido entre las líneas sólidas y líquidas. En este tramo permanecen en equilibrio las fases sólido y líquido.
Supresión de figura, originalmente imagen 2.
El procedimiento empleado para realizar estas determinaciones se desarrollará en el sistema cobre-níquel.
Este procedimiento se volverá relativamente fácil para conocer las fases presentes. Se localiza en el diagrama el punto definido por la temperatura y la composición y se identifican las fases presentes en este campo.
Los diagramas de fases son representaciones graficas, de las fases que existen en un sistema de materiales a varias temperaturas, presiones y composiciones. Los diagramas, en su mayoría, se han construido en condiciones de equilibrio, y son utilizados por ingenieros y científicos para entender y predecir muchos aspectos del comportamiento de los materiales. A continuación se hablará de algunos diagramas de fase de sustancias puras.
Muchos sistemas de aleaciones binarias tienen componentes que presentan solubilidad solida limitada de un elemento en otro, como lo es por ejemplo, el sistema plomo-estaño (Pb-Sn). Figura 14.
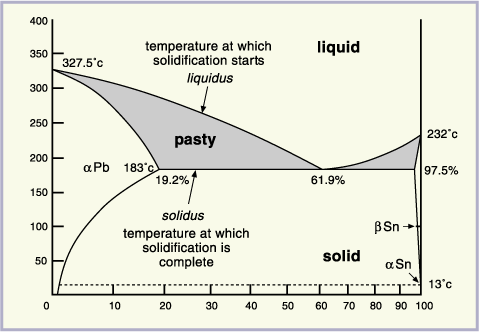
Figura 14. Diagrama Pb- Sn.
Este diagrama posee dos diferencias significativas con respecto al anterior:
1. Posee líneas de solubilidad: estas líneas indican cuando un componente precipita de otro de manera similar a como precipitara sal de una solución de agua salada a medida esta se enfría.
2. Posee un punto eutéctico: en este punto todo el liquido se transforma instantáneamente en solido. Debido a que la solidificación es rápida, no se da por nucleación y crecimiento por lo que el sólido que se forma resulta con una estructura diferente. A ese solido se le llama solido eutéctico. El sólido eutéctico se forma siempre a una misma temperatura, la cual se le llama temperatura eutéctica.
La solidificación de una aleación binaria con solubilidad limitada puede darse de las siguientes maneras:
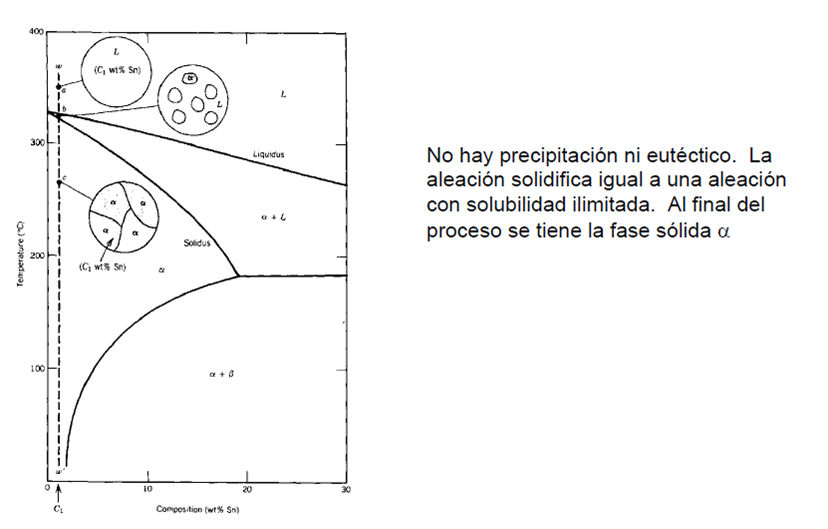
Figura 15. Solidificación.
Aleaciones que rebasan el límite de solubilidad: Las aleaciones que contienen entre 2 y 19% de Sn también solidifican y producen una solución sólida α. Sin embargo, al continuar enfriándose la aleación, se lleva a cabo una reacción en estado sólido, que permite que una segunda fase solida β precipite de la fase α original.
Aleaciones eutécticas: Las aleación que contiene 61.9% de Sn tiene la composición eutéctica, el termino eutéctico proviene del griego eutectos, que significa fácilmente fusible. En realidad, en un sistema binario que tiene una reacción eutéctica, una aleación con la composición eutéctica tiene la temperatura mínima de fusión. Es la composición para la cual no hay un intervalo de solidificación; La solidificación de esta aleación sucede a una temperatura, que en el sistema plomo-estaño es 183°C, la aleación es totalmente líquida y en consecuencia, debe contener 61.9% de Sn. Cuando el líquido se enfría a 183°C, comienza la reacción eutéctica.

Figura 16. Reacción eutéctica en diagrama Pb-Sn.
Se forman dos soluciones sólidas, α y β durante la reacción eutéctica. Las composiciones de ambas soluciones se dan en los extremos de la línea eutéctica. Durante la solidificación, el crecimiento del sólido eutéctico necesita tanto de la eliminación de calor latente de fusión como la redistribución, por difusión, de las dos distintas especies atómicas.
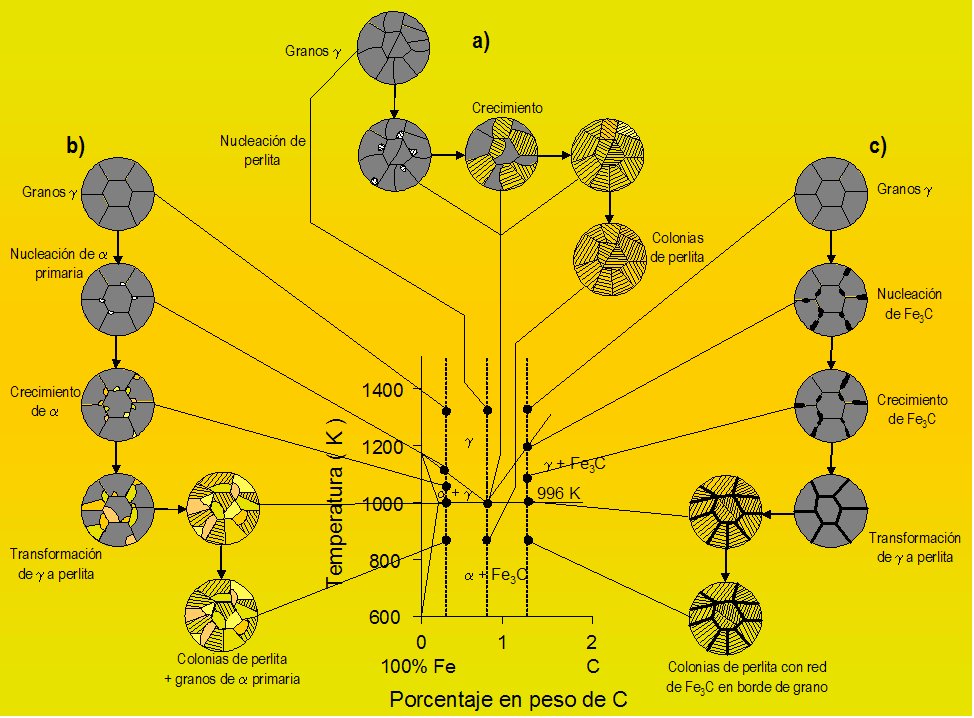
4.6.3. Diagrama Hierro Carbono.
El estado actual del diagrama de equilibrio de las aleaciones hierro−carbono fue establecido como resultado de las investigaciones hechas por varios científicos. La elaboración de este diagrama fue empezada por D. Chernov, quien estableció en 1968 los puntos críticos del acero. Más tarde volvió a estudiar reiteradamente este diagrama. N. Gutovski, M. Wittorft, Roberts Austen, Roozebom hicieron una gran aportación al estudio de este diagrama. Los últimos datos acerca del diagrama están expuestos en las obras de I. Kornilov.
Las aleaciones hierro−carbono pertenecen al tipo de aleaciones que forman una composición química. El carbono se puede encontrar en las aleaciones hierro−carbono, tanto en estado ligado (Fe3C), como en estado libre (C, es decir, grafito), por eso, el diagrama comprende dos sistemas:
• Fe−Fe3C (metaestable); este sistema está representado en el diagrama con líneas llenas gruesas y comprende aceros y fundiciones blancas, o sea, las aleaciones con el carbono ligado, sin carbono libre (grafito).
• Fe−C (estable); en el diagrama se representa con líneas punteadas; este sistema expone el esquema de formación de las estructuras en las fundiciones grises y atruchadas donde el carbono se encuentra total o parcialmente en estado libre (grafito).
Para estudiar las transformaciones que tienen lugar en aceros y fundiciones blancas se emplea el diagrama Fe−Fe3C, y para estudiar fundiciones grises, ambos diagramas (Fe−Fe3C y Fe−C). Temperatura a que tienen lugar los cambios alotrópicos en el hierro está influida por elementos de aleación, de los cuales el más importante es el carbono. Muestra la porción de interés del sistema de aleación hierro − carbono. Esta la parte entre hierro puro y un compuesto intersticial, carburo de hierro, Fe3C, que contiene 6.67 % de carbono por peso; por tanto, esta porción se llamará diagrama de equilibrio hierro − carburo de hierro. Este no es un verdadero diagrama de equilibrio, pues el equilibrio implica que no hay cambio de fase con el tiempo; sin embargo, es un hecho que el compuesto carburo hierro se descompondrá en hierro y carbono (grafito).
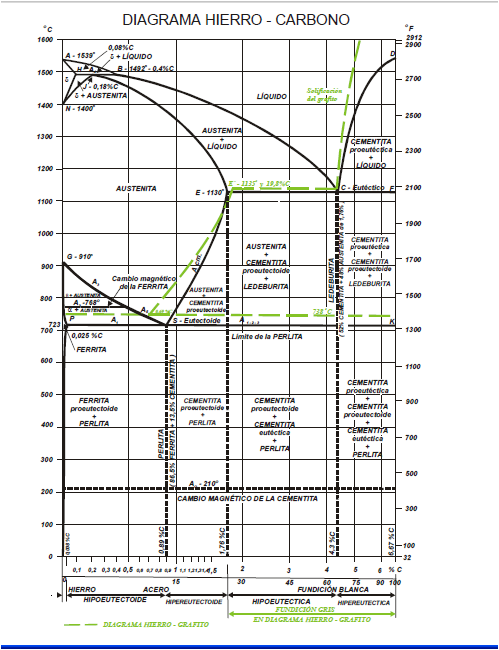
Figura 17. Diagrama Hierro- Carbono.
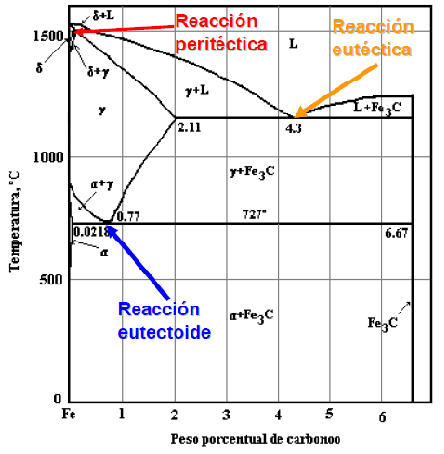
Figura 18. Puntos críticos en Diagrama Fe-C.
En el diagrama de equilibro, o de fases, Fe-C se representan las transformaciones que sufren los aceros al carbono con la temperatura, admitiendo que el calentamiento (o enfriamiento) de la mezcla se realiza muy lentamente de modo que los procesos de difusión (homogeneización) tienen tiempo para completarse. Dicho diagrama se obtiene experimentalmente identificando los puntos críticos —temperaturas a las que se producen las sucesivas transformaciones— por métodos diversos.
La reacción eutectoide más importante es la que se produce en los aceros. Es necesario contar con la comprensión definida de las reacciones eutécticas y las eutectoides, para poder entender lo referente a los aceros al carbono y para estar capacitados para interpretar debidamente el diagrama del hierro carburo de hierro que es, probablemente, el más importante de todos los diagramas de equilibrio de los metales.
Las fases y sus constituyentes que se encuentra en el diagrama del hierro carburo de hierro. Las fases que pueden encontrarse en condiciones de equilibrio son las líquidas, hierro ð, hierro y cementita. La fase líquida puede consistir en cualquier combinación de hierro y carburo, dentro de los límites de composición del diagrama. La cementita o carburo de hierro (Fe3C), es un compuesto químico de hierro y carbono que tiene 6.7 por ciento de este último elemento. Es uno de los componentes del sistema y, como tal, limita la cantidad de carbono que puede estar presente (100 por ciento de cementita equivale a 6.7 por ciento de carbono). La cementita es una fase extremadamente dura y frágil de una estructura cristalina compleja; no disuelve cualquier cantidad mensurable de carbono. El otro componente del diagrama, el hierro, existe dos alótropos sólidos o formas definidas de cristal. El hierro alfa, que es el alótropo a la temperatura ambiente, tiene una estructura cúbica centrada en el cuerpo, que se conoce también con el nombre de ferrita y constituye una fase suave y dúctil. El hierro gamma, o austenita tiene una estructura cúbica centrada en las caras y a veces se considera que es menos dúctil y ligeramente más dura que la ferrita, aunque, en realidad, no puede efectuarse una comparación verdadera. El hierro gama existe a temperaturas superiores a las que se encuentra el hierro alfa. Ambos tipos de hierro disuelven al carbono y los símbolos ð y se usan para representar, tanto al hierro puro, como a las soluciones sólidas de carbono en el hierro. Es conveniente hacer notar que, aunque el hierro gamma contiene hasta 2.0 por ciento de carbono, el hierro alfa puede disolver sólo 0.03 por ciento de carbono.
Las fases mencionadas arriba son también constituyentes. Además de éstos, existen otros dos constituyentes, la ledeburita y la perlita. La primera es el nombre que se da a la composición eutéctica sólida; se presenta únicamente en el hierro colado y, después de la transformación que se lleva a cabo al enfriarse a la temperatura ambiente, adquiere el aspecto moteado. La lebedurita transformada consiste en colonias de perlita en una red continua (llamada matriz) de cementita.
La perlita es un constituyente muy importante que se encuentra tanto en el acero como en el hierro colado. En la estructura eutectoide, que se compone de capas alternas de ferrita y cementita. La perlita tiene valores de dureza y ductilidad intermedios a los de la ferrita y la cementita.
Video 1. Ejemplo diagrama Hierro-Carbono.
Esta fórmula matemática consiste en encontrar las cantidades de % de sustancia en los diagramas de fases.
Estas cantidades normalmente se expresan como porcentaje del peso (% peso), y es válida para cualquier diagrama de fase binario. La regla de la palanca da a conocer la composición de las fases y es un concepto comúnmente utilizado en la determinación de la composición química “real” de una aleación en equilibrio a cualquier temperatura en una región bifásica.
En regiones de una sola fase, la cantidad de la fase simple es 100%. En regiones bifásicas se deberá calcular la cantidad de cada fase. Y la técnica es hacer un balance de materiales.
Para calcular las cantidades de líquido y de sólido, se construye una palanca sobre la isoterma con su punto de apoyo en la composición original de la aleación (punto dado). El brazo de la palanca, opuesto a la composición de la fase cuya cantidad se calcula se divide por la longitud total de la palanca, para obtener la cantidad de dicha fase.
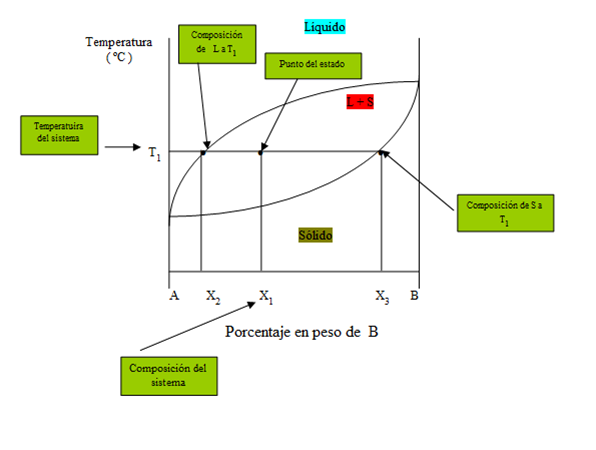
Figura 19. Diagrama general para aplicación regla de la palanca.
Si como en el ejemplo del diagrama se está a una temperatura T1 y con una composición del sistema X1% de B, se tendrá una mezcla de dos fases, L y S (líquido y sólido), se determinará la composición química de cada una y sus cantidades relativas. Así:
• Habrá en la fase L (líquido) a T1, un X2% en peso de B y (1- X2 ) % de A.
• La composición de la fase S (sólido) a T1 será de un X3% de B y un (1 – X3 )% de A.
Para determinar las cantidades relativas de L (líquido) y S (sólido) que hay a una temperatura y composición prefijadas se usará la regla de la palanca:
Nota importante:
Se puede utilizar la regla de la palanca en cualquier región bifásica de un diagrama de fases. En regiones de una fase no se usa el cálculo de la regla de la palanca puesto que la respuesta seria obvia ya que sería existente un 100% de dicha fase presente.
Video 2. Regla de la palanca en diagrama Hierro-Molibdeno.
4.6.5. Regla de fases de Gibbs.
A partir de consideraciones termodinámicas, J. W. Gibbs obtuvo una ecuación que permitía calcular el número de fases que pueden coexistir en equilibrio en cualquier sistema. Esta ecuación llamada regla de las fases de Gibbs, es
P + F = C + 2
Donde,
P = número de fases que pueden coexistir en el sistema
C = número de componentes en el sistema
F = grados de libertad
Usualmente, un componente C es un componente, un compuesto o una solución en el sistema. F son los grados de libertad, es decir número de variables como (presión, temperatura y composición) que se pueden cambiar independientemente sin variar el número de fases en equilibrio en el sistema.
Considere la aplicación de la regla de Gibbs al diagrama a continuación de fases presión-temperatura P-T del agua pura ver (Figura 20) en el punto triple coexisten tres fases en equilibrio y como hay un componente en el sistema (agua), se puede calcular el número de grados de libertad.
P + F = C + 2
3 + F = 1 + 3
F = 0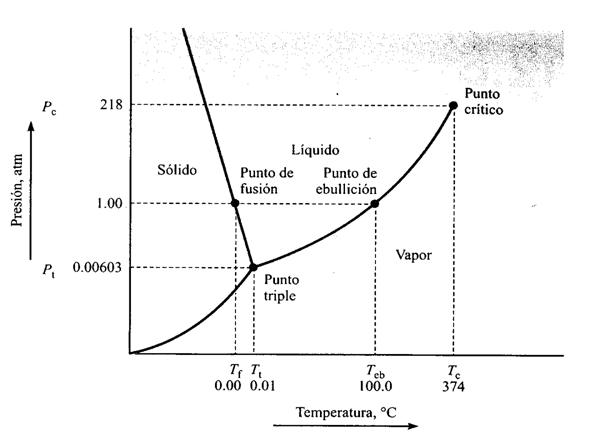
Figura 20. Diagrama de equilibrio de fases para el agua pura.
Como ninguna de las variables (presión o temperatura) se puede cambiar manteniendo el equilibrio al punto triple se le llama punto invariante.
Ahora se considera la curva de congelación solido-liquido (figura 19). En cualquier punto de esa línea coexisten dos fases. Así, aplicamos la regla de las fases,
2 + F = 1 + 2
F = 1
Este resultado indica que hay un grado de libertad y, por tanto, una variable (P o T) puede cambiarse de forma independiente manteniendo un sistema con dos fases que coexisten.
Los diagramas de fases binarios utilizados en la ciencia de los materiales son, en su mayoría, diagramas temperatura-composición, en los que la presión se mantiene constante, por lo general a 1 atm. En este caso, se tiene la regla se fases condensada, dada por
P + F = C + 1
Y como se puede observar el diagrama binario isomorfo de Cu y Ni de acuerdo con la regla de Gibbs (F = C – P + 1), a la temperatura de fusión de los componentes puros, el número de componentes C es 1 (ya sea Cu o Ni) y el número de fases disponible P es 2 (liquida o solida), lo cual indica que da un resultado de grado de libertad de 0 se denomina anteriormente como puntos invariantes. Significaría entonces que cualquier cambio de temperatura modificara la micro-estructura, ya sea a solida o liquida. Por consiguiente, en las regiones monofásicas (liquida o solida), el número de componentes C es 2, y el número de fases disponibles, P es 1, lo que da un grado de libertad de F = 2. Esto significa que se puede mantener la micro-estructura del sistema en esta región mediante la variación independiente de la temperatura o composición. En la región bifásica, el número de componentes, C es de 2, y el número de fases disponibles, P es 2, lo que da un grado de libertad de F = 1. Esto significa que solo una variable (ya sea temperatura o composición) puede modificarse independientemente del tiempo que se mantiene la estructura bifásica del sistema. Si se modifica la temperatura, la composición de las fases también cambiaran.
Si se representa en unos ejes de coordenadas las temperaturas y el tiempo transcurrido desde el estado líquido al sólido se puede ver la variación de velocidad de solidificación que experimenta la aleación al pasar por una curva de fase.
En la grafica siguiente se muestran las curvas de enfriamiento correspondientes al 100% de A, 50% de A y 100% de B.
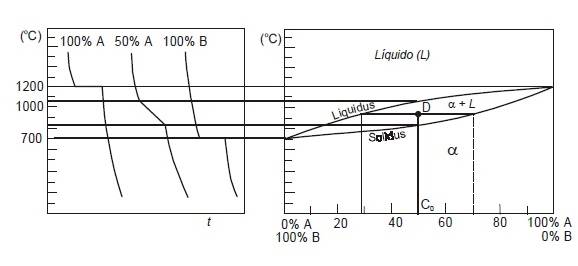 En los metales puros y en aquellas concentraciones que den lugar a un punto eutéctico, la temperatura permanece constante hasta que se ha producido toda la solidificación.
En los metales puros y en aquellas concentraciones que den lugar a un punto eutéctico, la temperatura permanece constante hasta que se ha producido toda la solidificación.
4.8. Ejercicios.
4.8.1. Regla de la palanca.
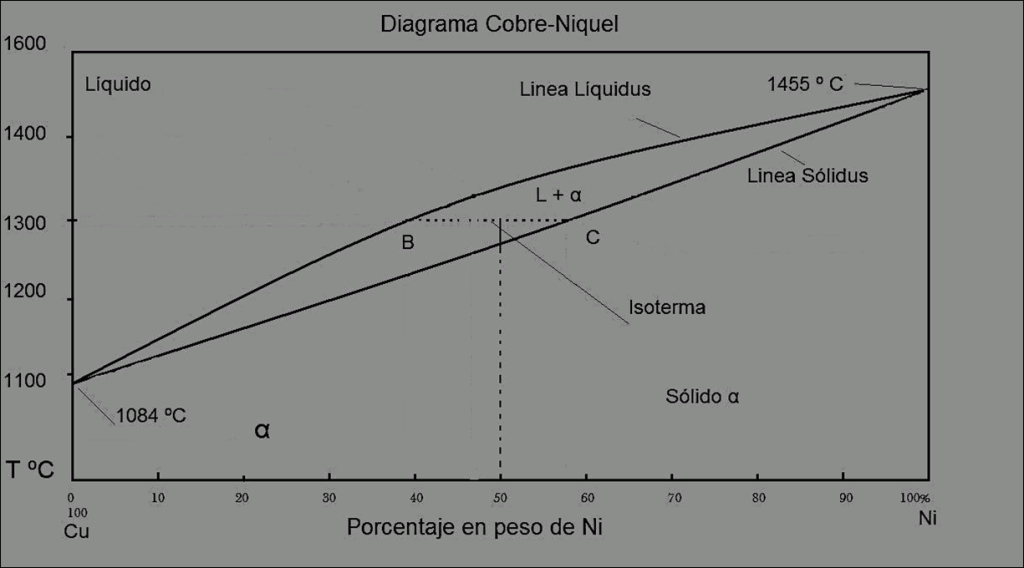
1)
Una aleación de cobre – níquel contiene 53% en peso de Cu y 47% de Ni y está a 1.300 °C.
Utilizando la siguiente figura responder lo siguiente:
a) ¿Cuál es el porcentaje en peso de cobre en las fases sólida y líquida a esta temperatura?
b) ¿Qué porcentaje en peso de la aleación es líquida, y qué porcentaje es sólida?
Solución:
a)
% Cu en fase líquida: 61% Cu
% Cu en fase sólida: 43% Cu
Xs = (w0 – wl) / (ws – wl)
b)
Se toma de referencia en este caso el Níquel
w0 = 47% wl = 39% ws = 57%
Xs = (47 – 39) / (57 – 39) x100% = 44%fase solida
Xl = (ws – w0) / (ws – wl) = (57 – 47) / (57 – 39) x100%= 56% fase liquida
2.
Se tiene 200 kg de Cu-Ni con 50% de Ni a 1300 ºC, con base al siguiente diagrama.
Determinar:
a) Porcentaje que hay de la fase α y fase líquida.
b) Cuantos kilogramos.
c) Composición de cada fase:
Solución:
Ni = 50% = 100 kg
Cu = 50% = 100 kg
Se toma de referencia el Níquel
wl = 40% w0 = 50% ws = 59% a 1300 ºC
Xs= (w0 – wl) / (ws – wl) Porcentaje Sólido
Xl = (ws – w0) / (ws – wl) Porcentaje Líquido
a) Xs = (50 – 40) / (59 – 40) = 53% fase solida
Xl = (59 – 50) / (59 – 40) = 47% fase liquida
b) % fase α x 200 kg = 106 kg
% fase L x 200 kg = 94 kg
c) De fase Sólida α De fase Líquida L
Cu = 41% Cu = 60%
Ni = 59% Ni = 40%
3.
Se desea saber las fases presentes y su composición, utilizando el diagrama de fases de Fe-C.
a) En una aleación con un 1% C, con temperatura de 600 y 960 °C.
b) En una aleación con el 2% C, a una temperatura de 900|C.
Solución:
a) A 600 °C:
%Fe α=( 6.67-1/6.67-0,067 *100)= 85.87%
%Fe3C=( 1- 0.067/6.67-o.o67)*100=14.13%
A 960°C nos encontramos con 100% de Austenita.
b) En la aleación con el 2% de carbono, a temperatura de 960 °C, nos encontramos con Austenita y Cementita.
% Austenita =( 6,67- 2/6.67-1.5)= 9.67%
4.
Una fundición de ferrita con 3% de C. Se encuentra en equilibrio a una temperatura ambiente. Se sabe que la solubilidad de C en el Feα a la temperatura ambiente es de 0.008%. Determinar:
a) Fases presentes en su composición
b) Cantidades relativas de cada una.
Solución:
a) Concentración del 3% de C
Ferrita (Feα) + Cementita (Fe3C)
b) Ferrita (Feα): 0.008%
Cementita (Fe3C): 6.67%
WFeα=(6.67-376.67-0.008)*100=55%
WFe3C= 1-0.55*100= 45%
5.
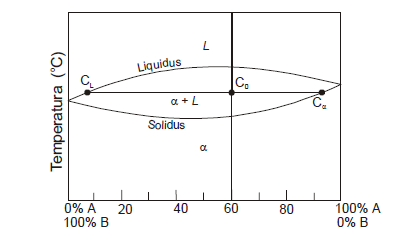
Una hipotética aleación de composición de 60% de A y 40% de B, esta a una temperatura en la que coexisten una fase sólida α y la otra líquida. Si las fracciones másicas de ambas son 0-66 y 0.34, respectivamente, y , la fase α contiene un 13% de componente de B y un 87% de A. Determine la composición de fase líquida a dicha temperatura.
Solución:
Si se denomina:
CL a la concentración de la fase líquida
CLA a la concentración de la fase líquida con un % de A
CLB a la concentración de la fase líquida con un % de B e igualmente en la fase sólida Cα, CαA,CαB.
La fase sólida en función en las concentraciones Wα= C0-CL/Cα-CL
Por lo que en función del componente A WαA= C0- CLA/CαA-CLA
0.66= 0.6-CLA/0.87-CLA: CLA=7.58% de A
CLB = 100- 7.58=92.42% de B.
4.8.2. Diagrama plomo estaño.
1.
Determine:
a) la solubilidad del estaño en Plomo sólido a 100°C.
b) La solubilidad máxima del plomo en el estaño sólido.
c) La cantidad β que se forma si una aleación Pb-10%Sn se enfría a 0°C.
d) Las masas del estaño contenido en las fases α y β. Suponga que la masa total de aleación Pb-10%Sn es de 100 gramos.
SOLUCIÓN:
Diagrama Pb-Sn.
a) La temperatura de 100°C intercepta la curva solvus en 5% de Sn. La solubilidad del estaño (Sn) en el plomo (Pb) a 100°C es, por consiguiente de 5%.
b) La solubilidad máxima del plomo (Pb) en el estaño (Sn) que se determina desde el lado rico de Sn del diagrama de fases, está en la temperatura eutéctica de 183°C y es de 97.5% de Sn.
c) A 0°C, la aleación con 10% de Sn está en la región α+β del diagrama de fases. Si trazamos una línea de enlace y se aplica la regla de la palanca encontramos que %β=[(10-2)/(100-2)]*100=8.2%. Obsérvese que la línea de enlace cruza la curva solvus de solubilidad de Pb en Sn al lado derecho del campo de la fase β a una concentración de Sn distinta de cero, sin embargo, no se puede leer con exactitud en el diagrama. Por consiguiente supondremos que el punto del lado derecho de la línea de enlace es 100% de Sn. El % de α seria (100-%β)=91.8%. Esto significa que si tenemos 100 gramos de la aleación con 10% de Sn consistirá en 8.2 gramos de la fase β y 91.8 de la fase α.
d) Observe que 100 gramos de la aleación consistirán en 10 g de Sn y 90 g de Pb. El Pb y el Sn se distribuyen en dos fases es decir, α y β. La masa de Sn en la fase α=2%Sn*91.8 g de fase α =0.02*91.8 g=1.836 g. Como el estaño (Sn) aparece en las dos fases, la masa de Sn en la fase β será =(10- 1.836) g=8.164 g. Observe que en esta caso la fase β a 0°C es casi Sn puro.
e) Se calcula ahora la masa del Pb en las dos fases. La masa de Pb en la fase α será igual a la masa de la fase α menos la masa Sn en esa fase = 91.8 g – 1.836 g =9.964 g. También se puede calcular de la siguiente manera, masa de Pb en la fase α = 98% Sn*91.8 g de fase α = o.98*91.8 g = 89.964 g. Se conoce la masa total del plomo en la fase α, por consiguiente, la masa de Pb en la fase β = 90-89.964 = 0.036 g. Esto coincide con lo que se dijo antes, que la fase β en este caso es casi Sn puro.
NOTA IMPORTANTE: Para efectos de cálculos, se considera si se está en calentamiento y se encuentra que el punto a analizar se encuentra sobre una línea de cambio de fase, se considera que ya se presenta la fase siguiente y allí se traza la línea de análisis. Si se está en enfriamiento tener presente la anterior consideración.
2.
a) Determine la cantidad y la composición de cada fase en una aleación plomo – estaño de composición eutéctica.
b) calcule la masa de las fases presentes.
c) Calcule la cantidad de Pb y Sn en cada fase, suponiendo que tiene 200 gramos de aleación.
SOLUCIÓN:
a) La aleación eutéctica contiene 61.9% de Sn. Aplicando la regla de la palanca a una temperatura justo abajo de la eutéctica (caso de enfriamiento), 182°C, el punto de apoyo de la palanca es 61.9% de Sn. Los extremos de la línea de enlace coinciden aproximadamente con los extremos de la línea eutéctica.
α = (Pb-19% Sn) % α = [(97.5-61.9)/(97.5-19)]*100 = 45.35 %
β = (Pb -97.5% Sn) % β = [(61.9-19)/(97.5-19)]*100 = 54.65 %
O bien se puede decir que la fracción en peso de la fase α = 0.4535, y la fracción de la fase β = 0.5565
Una muestra de 200 g de la aleación contendrá un total de 200 g * (0.6190) = 123.8 g de Sn y os 76.2 g restantes de plomo. La masa total de plomo y estaño no pueden cambiar, por la ley de conservación de la masa; lo que cambia es la masa del plomo y el estaño en las distintas fases.
b) A una temperatura justo abajo de la eutéctica: La masa de la fase α en 200 gramos de aleación = 200 g * o.4535 = 90.7 g. La cantidad de fase β en 200 g de la aleación = (masa de la aleación – masa de la fase α) = 200.o g – 90.7 g = 109.3 g. También se podría haber expresado como: cantidad de fase β en 200 g de la aleación = 200 g * 0.5465 = 109.3 g. Así, a una temperatura justa abajo de la eutéctica, es decir 182°C, la aleación contiene 109.3 g de fase beta y 90.7 g de fase alfa.
c) Se calcula ahora las masas de plomo y estaño en las fases alfa y beta: Masa de plomo en la fase alfa = masa de la fase alfa en 200 g * (concentración de Pb en alfa), entonces la masa de Pb en la fase alfa = (90.7 g)*(1-0.190) = 73.467 g. Ahora la masa de Sn en la fase alfa = masa de la fase alfa – masa de Pb en la fase alfa, entonces masa de Sn en la fase alfa = (90.7-73.467 g) = 17.233 g.
masa de Pb en la fase beta = masa de la fase beta en 200 g *(fracción de peso de Pb en beta), entonces la masa de Pb en la fase beta = (109.3 g)* (1-0.175)=2.73 g. Ahora la masa de Sn en la fase beta = la masa total de Sn – masa de Sn en la fase alfa=123.8 g-17.233 g=106.57 g.
Obsérvese cómo se obtuvo el mismo resultado a partir del balance de masa total de plomo, como sigue:
Masa total de plomo en la aleación = la masa de plomo en la fase alfa + masa de plomo en la fase beta.
76.2 g = 74.467 g + masa de plomo en la fase beta
3.
Se tiene 400 kilogramos de una aleación plomo-estaño en proporciones 60-40 calcule a temperatura del eutéctico en enfriamiento, las fases presentes, % de las fases, % de los componentes por cada fase y peso de los componentes en cada fase.
Aleación general 400 kilogramos……….. 60% de Pb=240 kilogramos + 40% de Sn = 160 kilogramos.
A temperatura del eutéctico….183°C para enfriamiento.
%α=[(97.8-40)/(97.8-18.3)]*100=72.7%
%β=[(40-18.3)/(97.8-18.3)]*100=27.3%
Peso de α=0.723*400=290.8 kilogramos.
Peso de β=0.273*400=109.2 kilogramos.
% de cada componente en la fase α……81.7% de Pb + 18.3% de Sn.
% de cada componente en la fase β…….2.2% de Pb + 97.8% de Sn.
Peso de cada componente en la fase α de la aleación.
Pb=0.817*290.8 kilogramos=237.58 kilogramos.
Sn=0.183*290.8 kilogramos=53.210 kilogramos.
Peso de cada componente en la fase β de la aleación.
Pb=0.022*109.2 kilogramos=2.40 kilogramos.
Sn=0.978*109.2 kilogramos=106.97 kilogramos.
4.
Un kilogramo de una aleación de 70% de Pb y 30% de Sn, se enfría lentamente a partir de 300°C utilice el diagrama de fases Pb-Sn y calcule:
a) el porcentaje en peso de líquido y del proeutéctico alfa a 250 °C.
b) El porcentaje en peso de líquido y del proeutéctico alfa justo por encima de la temperatura eutéctica y el peso en kilogramos de esas fases.
SOLUCIÓN
a) Del diagrama plomo-estaño
% en peso de liquido=[(30-12)/(40-12)]*100=64%
% en peso proeutéctico alfa=[(40-30)/(40-12)]*100=36%
b) El porcentaje en peso de líquido y proeutéctico alfa justo por encima de la temperatura eutéctica es:
% en peso de liquido=[(30-19.2)/(61.9-19.2)]*100=25.3%
% en peso proeutéctico alfa=[(61.9-30)/(61.9-19.2)]*100=74,7%
Peso de la fase liquida=1 Kg*0.253=0.253 kilogramos.
Peso de proeutéctico alfa=1 Kg*0.747=0.747 kilogramos.
5.
Una aleación de plomo-estaño contiene 64% en peso de material proeutéctico alfa y 36% en peso de material eutéctico α+β a 183 °C calcule la composición promedio de esta aleación.
SOLUCIÓN:
Suponga que x es el porcentaje en peso de Sn en la aleación desconocida. Puesto que esta aleación contiene 64% en peso de proeutéctico α, la aleación debe ser hipoeutéctica y x por lo tanto estará localizada entre 19.2 y 61.9% en peso de Sn, como Aparece en los diagramas plomo-estaño, utilizando la regla de la palanca se tiene:
% proeutéctico α = [(61.9-x)/(61.9-19.2)]*100=64%
61.9 -x = 0.64 (42.7) = 27.3
x = 34.6%
De este modo la aleación está formada por 34.6% de Sn y 65.4 % de Pb. Obsérvese que se utiliza el cálculo de la regla de la palanca por encima de la temperatura eutéctica ya que el porcentaje de proeutéctico α, permanece constante tanto por encima como por debajo de la temperatura eutéctica.
4.9.1. Nota Histórica: Hierro y Acero
El hierro se descubrió en algún momento de la edad del bronce. Probablemente se sacó de entre las cenizas de fuegos encendidos cerca de los depósitos de minerales de hierro. La ubicación del metal creció, sobrepasando finalmente al bronce en importancia. La edad del hierro se ubica generalmente alrededor del año 1200 a.C . Mediante hallazgos de artefactos hechos de hierro en la gran pirámide de Gizeh en Egipto, que data del 2900 a.C.
En Israel se han descubierto hornos para el beneficio del hierro que datan del 1300a.C. en Asiria ( al norte de Irak ) se fabricaron por el año 1000 a. C. carros de hierro, espadas y herramientas. Los romanos heredaron el trabajo del hierro de sus provincias.; principalmente de Grecia, y desarrollaron la tecnología a nuevas alturas y la difundieron a través de Europa. Las antiguas civilizaciones aprendieron que el hierro era más duro que el bronce y que adquiría un mejor filo y más fuerte.
La invención del cañón en Europa durante la Edad Media creó la primera demanda real del hierro: sólo hasta entonces el uso del hierro sobrepasó finalmente del cobre y del bronce. También la estufa de fundición de hierro, como artículo doméstico de los siglos XVII y XVIII. Contribuyó a incrementar significativamente la demanda de hierro.
Durante el siglo XIX, industrias como la construcción, los ferrocarriles, la construcción de barcos, la maquinaria y la industria militar, crearon un dramático crecimiento en la demanda de hierro y acero en Europa y en América. No obstante que fue posible producir grandes cantidades de arrabio (crudo) en los altos hornos, los procesos subsiguientes para producir hierro forjado y acero eran lentos. La necesidad de incrementar la productividad de estos metales básicos fue la “madre invención”. Henry Bessemer desarrolló en Inglaterra el proceso para soplar aire a través del hierro fundido que condujo a la invención del convertidor Bessemer (patentado en 1856). Los hermanos Pierre y Emile Martin construyeron en Francia el primer horno de hogar abierto en 1864. Estos métodos permitieron producir hasta 15 toneladas de acero en un solo lote (hornada), un adelanto significativo sobre los métodos anteriores. La expansión de los ferrocarriles en Estados Unidos después de la Guerra Civil creó una enorme demanda de acero. Entre 1880 1890 se empezaron a usar las vigas de acero para la construcción en cantidades significativas la construcción en cantidades significativas. Las construcción de rascacielos empezó a depender de este acero estructural.
Hacia el final del siglo XIX. Fue posible disponer de electricidad en cantidades suficientes, se usó esta fuente de energía para producir acero. El primer horno eléctrico comercial para la producción de acero se puso en operación en Francia en 1899. Para 1920, éste se había convertido en el principal proceso para fabricar acero de aleación.
El uso de oxígeno puro en la producción de acero se inició un poco antes de la Segunda Guerra Mundial en varios países europeos y en Estados Unidos. Los trabajos en Austria después de la guerra culminaron con el desarrollo del horno básico de oxígeno (BOF, por sus siglas en inglés de basic oxygen furnace).Éste se ha convertido en la tecnología moderna para producir acero. Alrededor de 1970 sobrepasó al método de hogar abierto. El convertidor Bessemer había sido superado en 1920 por el método de hogar abierto, y dejó de ser un método de producción comercial de acero 1971.

Figura 21. Hombre y proceso de fundición.
4.9.2. Clasificación y definición de aceros y fundiciones.
Nomenclatura AISI-SAE.
La norma AISI/SAE (también conocida por SAE-AISI) es una clasificación de aceros y aleaciones de materiales no ferrosos. Es la más común en los países de Latinoamérica entre los que se encuentra Colombia. La norma surge por la necesidad de manejar una sola nomenclatura unificada debido a que se manejaba en todos los países nomenclaturas distintas para diferentes aceros. Lo que conllevaba a la confusión e inclusive a la utilización de los aceros en maquinas, vehículos o en otro tipo de estructuras con diferentes características ya que no era el necesario para el dispositivo.
De igual manera, cada nomenclatura tiene sus iniciales, la AISI es designado en ingles como American Iron and Steel Institute (Instituto americano del hierro y el acero), mientras que SAE es designado en inglés como Society of Automotive Engineers (Sociedad Norteamericana de Ingenieros Automotores).
Entre otras designaciones se encuentran:
ASME (American Society of Mechanical Engineers), ANSI(American National Standards Institute), ACI(Alloy Casting Institute) , AWS(American Welding Society) en la designación de los aceros y sus normas de fabricación para diferentes productos.
Igualmente, en este sistema los aceros se clasifican con cuatro dígitos. El primero especifica la aleación principal, el segundo indica el porcentaje aproximado del elemento principal y con los dos últimos dígitos se conoce la cantidad de carbono presente en la aleación. Ejemplo: 1045 AISI SAE tiene 0,45 porcentaje de Carbono.
La aleación principal que indica el primer dígito es la siguiente:
1. Carbono es un elemento principal su ubicación en la tabla periódica es de grupo A
2. Níquel
3. Níquel-Cromo, principal aleante el cromo
4. Molibdeno
5. Cromo
6. Cromo-Vanadio, principal aleante el cromo
7. Esta numeración indica que son aceros resistentes al calor, pero estos no se fabrican habitualmente.
8. Níquel-Cromo-Molibdeno, principal aleante el molibdeno
9. Silicio
Por otra parte, en las normas ASTM, para referirse a los distintos aceros, se puede hablar de “Grado”, “Clase” o “Tipo”. Por ejemplo A106 Grado A, A48 Clase 20A, A276 Tipo 304.
Por otra parte, los códigos numéricos o alfanuméricos usados para referirse a un acero, a veces tienen algo de significado. En los grados designados por letras del alfabeto A, B, C,.. el contenido de carbono y su resistencia mecánica aumentan en el mismo orden. En las clases, del código numérico indica su tensión de ruptura en PSI. La designación de un mismo acero también cambia según se trate de un producto laminado, forjado (se usa nomenclatura AISI, Ejemplo TP304 para tubos y cañerías, F304 para piezas forjadas, WP304 y CR304 para fittings) o un producto fundido (se usa nomenclatura ACl, Por Ejemplo CF8 para el cuerpo fundido de una válvula, no se dice “304 fundido”).
De igual manera, esta gran diversidad y falla de sistematización se trata de resolver, mediante un sistema de numeración unificado UNS (Unifred Numbering System) acordado entre ASTM y SAE, que poco a poco se ha ido divulgando. Actualmente se considera acero a una aleación cuyo contenido porcentual de hierro, en peso, es superior al de cualquier otro componente de la aleación y con un contenido de carbono que no supere el 1,76%, sin embargo, si se supera esta cantidad de carbono entraríamos en la zona de las fundiciones.
Cabe mencionar, que en el diagrama de hierro carbono si hablamos de un material que tenga un porcentaje de carbono menor al 1,76% estaremos hablando de la zona de los aceros, si se supera dicho valor hablaremos de la zona de las fundiciones.
En los aceros aleados los dos primeros dígitos indican los principales elementos de aleación y sus rangos. A veces se intercalan letras después de los dos primeros dígitos para indicar otra característica (B indica Boro, L indica Plomo). También pueden usarse prefijos( M indica calidad corriente, E indica horno eléctrico, H indica endurecible). En la siguiente tabla se muestra muchos de los ejemplos de la nomenclatura del acero.
Aceros al Carbono Descripción
1OXX no-resulfurado, 1.00 Mn máx
IlXX Resulfurado
Diagrama de fases de equilibrio: representación gráfica de temperaturas y composiciones para las cuales varias fases son estables en el equilibrio. En la ciencia de materiales, los diagramas de fases más comunes describen a la temperatura versus composición.
Equilibrio: un sistema está en equilibrio si no tiene lugar cambios microscópicos con el tiempo.
Fase: una porción física homogénea y diferente de un sistema material.
Grados de libertad F: número de variables (temperatura composición y presión) que se pueden variar independientemente sin cambiar la fase o fases del sistema.
Isoterma: línea horizontal trazada en una región bifásica de un diagrama de fases, para ayudar a determinar las composiciones de ambas fases.
Líquidus: temperatura a la cual el líquido empieza a solidificarse bajo condiciones de equilibrio.
Matriz: por lo general, fase sólida continúa en una microestructura compleja. Dentro de la matriz se pueden formar precipitados sólidos.
Número de componentes de un diagrama de fases: número de elementos que constituyen el sistema del diagrama de fases. Por ejemplo Fe-Ni un sistema de dos componentes.
Precipitado: fase solida que se forma de la fase matriz original cuando se excede el límite de solubilidad. En la mayoría de los casos, se trata de controlar la formación del precipitado para producir el endurecimiento por dispersión óptimo.
Punto triple: presión y temperatura a las cuales las tres fases de un solo material están en equilibrio.
Reacciones invariantes: transformaciones de fase en equilibrio que se suponen cero grados de libertad.
Regla de la palanca: los porcentajes en pesos de las fases en cualquier región de un diagrama de fases binarios se pueden calcular usando esta regla si prevalecen las condiciones de equilibrio.
Regla de las fases de Gibbs: establece que en el equilibrio del número de fases más los grados de libertad es igual al número de componentes más 2, P + F = C + 2. De forma abreviada, con la presión 1= atm, P + F = C + 1.
Sistema isomorfo: un diagrama de fases en el cual solo existe una única fase sólida, esto es, hay solo una estructura en estado sólido.
Sistema: una porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas.
Sólidus: temperatura durante la solidificación de una aleación a la cual la última parte de la fase liquida se solidifica.
Solubilidad limitada: condición referente a que sólo se puede disolver una cantidad máxima de un material soluto en un material solvente.
Solubilidad: cantidad de material que se disolverá completamente en un segundo material, sin crear una segunda fase.
Solvus: línea de solubilidad que separa una región que tiene una fase solida de una región que tiene dos fases solidas en el diagrama de fases.
Créditos
Recopilación y edición realizada por Juliana Galeano Monsalve, Jessica Agudelo Bedoya, Javier Arévalo Parra, estudiantes de ingeniería mecánica de la Universidad Tecnológica de Pereira 2012.
Revisión y segunda edición realizada por Laura Fernanda Medina, Andrés Camilo Obando y Oscar Manso, estudiantes de Ingeniería Mecánica, Universidad Tecnológica de Pereira 2015.
Revisión y tercera edición realizada por Laura Fernanda Medina, Juan Sebastian Cardona y Juan David Villegas Osorio , estudiantes de Ingeniería Mecánica, Universidad Tecnológica de Pereira Julio, 2015.
•Fundamentos de la ciencia e ingeniería de materiales. – 4ª ED. Smith, William F. (Autor), Hashemi, Javad (Autor)
•Ciencia e ingeniería de los materiales. – 2ª y 4ª ED. Askeland, Donald R. (Autor), Phule, Pradeep P. (Autor)
•Apuntes de metalografía 1, Manuel Pinzón Candelario, Facultad de ingeniería mecánica, Universidad Tecnológica de Pereira.
•Figura 1. Micro-estructuras, http://www.upv.es/materiales/Fcm/Fcm13/Imagenes/Fig13-2.jpg
•Figura 2. Solución sólida, http://dimetilsulfuro.es/2013/12/10/estatuas-bronce-historia/
•Figura 3. Diagrama límite de soludibilidad, https://ingelibreblog.wordpress.com/2014/01/15/introduccion-a-los-diagramas-de-fase/g
•Figura 4. Diagrama de fase del agua, http://4.bp.blogspot.com/-4B5vvDJk1QY/TzI1wXFWCHI/AAAAAAAADI8/cxNPjPfHPpY/s1600/diagrama-de-fases-del-agua.png
•Figura5. Diagramade Fase binario Cu-Ni, https://ingelibreblog.files.wordpress.com/2014/01/cu-ni-1.jpg
•Figura 6. Diagrama de fase binario Ag-Cu, https://tecnokrs.files.wordpress.com/2012/02/diagrama-cu-ag.jpg
•Figura 7. Reacciones invariantes, http://ocw.uc3m.es/ciencia-e-oin/quimica-de-los-materiales/Material-de-clase/imagenes/metales/a_metales7.gif
•Figura 8. Diagrama de solubilidad total, http://www.unedcervera.com/c3900038/ciencia_materiales/diagramas_fases_2.png
•Figura 9. Diagrama solubilidad parcial, http://www.unedcervera.com/c3900038/ciencia_materiales/diagramas_fases_5.png
•Figura 10. Proceso de solidificación, https://encrypted-tbn3.gstatic.com/images?q=tbn:ANd9GcS4RLBR1uP8Ch_bKMYOt_4Xsr_mZ3wTkGmpnL0YFsMxBMKDLryh5w
•Figura 11. Curva de solidificación, http://foundrynews.com.br/media/ckfinder/userfiles/images/01-07-2014/Figura_04.png
•Figura 12. Crecimiento planar, http://gida.wikispaces.com/file/view/Imagen3.jpg/205042316/Imagen3.jpg
•Figura 13. Diagrama Cu-Ni, http://cosmolinux.no-ip.org/uned/figura25.JPG
•Figura 14. Diagrama Pb-Sn, http://www.mtarr.co.uk/courses/topics/0224_tsm/images/met_sm_imga.gif
•Figura15. Solidificacion. https://cienciamateriales.files.wordpress.com/2012/08/diagrama-de-fases-4.pdf
•Figura 16. Reacción eutéctica en diagrama Pb-Sn, https://www.uam.es/docencia/labvfmat/labvfmat/practicas/practica1/eutectico_archivos/image002.jpg
•Figura 17. Diagrama Hierro-Carbono. http://ingemecanica.com/tutorialsemanal/tutorialn100.html
•Figura 18. Sin referencia encontrada.
•Figura 19. Diagrama general para aplicación de regla de la palanca, https://encrypted-tbn3.gstatic.com/images?q=tbn:ANd9GcTPACpsY23DND-HbW9qkM8HZMXYd07QS5VbbYrxqZoiPdEUP3Du
•Figura 20. Diagrama de equilibrio de fases para el agua pura, http://rodas.us.es/file/7a35eedc-8588-e23b-14be-b77099d004e8/1/tema10_ims_SCORM.zip/images/pic024.gif
•Figura 21. Hombre y proceso de fundición, https://encrypted-tbn2.gstatic.com/images?q=tbn:ANd9GcQsdY_WCoxmMDIaSEIz3Y6Xp0d-XEZF4uI-Wn0U-h6Qb8VeUcJGUg • Video 1. Ejemplo diagrama Hierro-Carbono, https://www.youtube.com/watch?v=wvHW9S-puUE •Video 2. Regla de la palanca en diagrama Hierro-Molibdeno, http://youtu.be/A41-C-MZU48
•http://cienciamateriales.argentina-foro.com/t120-27-sistema-binario-de-solubilidad-parcial-concepto-de-eutectico-caracteristicas
•Solidificación:http://www.comosehace.cl/procesos/PaulinaCecci/complemento_Solidificacion.htm
•http://ocw.uc3m.es/ciencia-e-oin/tecnologia-de-materiales-industriales
•http://metalografia.comli.co/Nocions%20diagrames%20de%20fase.html
•http://cabierta.uchile.cl/revista/23/articulos/pdf/edu1.pdf
•http://thebookshq.com/books/diagramas-de-fases-cobre-niquel.html
•http://www.uam.es/docencia/labvfmat//labvfmat/practicas/practica1/palanca_archivos/palanca.htm
•http://www.diquima.upm.es/docencia/tqg/docs/regla_palanca.pdf
ANEXOS
• Ciencia e Ingeniería de los materiales; Smith
• Ciencia e Ingeniería de los materiales; Askeland
• Fundamentos de Manufactura Moderna ; Mikell P.Groover
• Ciencia e Ingeniería de los materiales ; Callister
• Problemas y cuestiones de tecnología Industrial.