Tabla de contenido
1.Generalidades de los materiales. 1.1.Sustancias puras. 1.1.1.Elementos quimicos. 1.1.2.Compuestos quimicos. 1.2.Mezclas (sustancias no puras). 1.2.1.Mezclas homogeneas. 1.2.1.1.Separacion de mezclas homogeneas. (Cristalizacion, destilacion, evaporacion.). 1.2.2.Mezclas heterogeneas. 1.2.2.1.Separacion de mezclas heterogeneas. 1.2.2.1.1.Filtracion. 1.2.2.1.2.Decantacion. 1.2.2.1.3.Separacion magnetica. 1.2.2.1.4.Tamizacion. 1.2.2.1.5.Levigacion. 1.2.2.1.6.Sedimentacion. 1.2.2.1.7.Flotacion. 1.3.Enlaces quimicos. 1.3.1.Atomo. 1.3.2.Molecula. 1.3.3.Especie quimica. 1.3.4.Elementos quimicos. 1.3.5.Clasificacion de los elementos quimicos. 1.3.6.Propiedades fisicas y quimicas de los elementos. 1.3.6.1.Simbolo. 1.3.6.2.Masa atomica. 1.3.6.3.Numero atomico. 1.3.6.4.Numero de neutrones. (isotopos) 1.3.6.5.Estructura o configuracion electronica. 1.3.6.6.Electrones en los niveles de energia. 1.3.6.7. Número de oxidación. 1.3.6.8. Electronegatividad. 1.3.6.9. Energía o potencial de ionización. 1.3.6.10. Afinidad electrónica o electroafinidad. 1.3.6.11. Radio atómico. 1.3.6.12. Numero de valencia. 1.3.7.Clasificación. 1.3.8.Enlaces químicos. 1.3.9.Distintos tipos de enlaces. 1.3.9.1. Enlace iónico. 1.3.9.2. Enlace covalente. 1.3.9.3. Enlace metálico. 1.3.10.Conductividad. 1.4.Materiales de ingenieria. 1.4.1.Metales. 1.4.2.Polímeros. 1.4.3.Cerámicos. 1.4.4.Materiales compuestos. 1.4.5 Materiales de origen biológico.
Lista de figuras
figura numero nombre
1 Sustancias puras 2 Elementos quimicos 3 Compuesto quimico 4 Compuesto quimico 5 Mezclas 6 Mezclas homogeneas 7 Cristalizador 8 Alambique 9 Evaporador 10 Filtrador 11 Decantador 12 Iman 13 Tamiz 14 Personas levigando 15 Sedimentador 16 Flotacion 17 Atomo 18 Molecula 19 Especie quimica 20 Tabla periodica 21 Escandio (simbolo) 22 Masa atomica 23 Escandio (numero atomico) 24 Numero de oxidacion
1. GENERALIDADES DE LOS MATERIALES.
En este capítulo se estudia los temas que conciernen los materiales puros y no puros, enlaces químicos así como también los materiales que son utilizados para satisfacer algunas necesidad en la ingeniería.
Para tal fin se inicia en una primera instancia definiendo el término de sustancia: una sustancia es cualquier variedad de materia de composición definida y reconocible. las Podemos clasificar en sustancias puras y mezclas.
1.1 Sustancias puras.
Las sustancias puras están formadas por partículas (átomos o moléculas) iguales, tienen una composición fija, no pueden separase por medios físicos. Sus propiedades son específicas, bien definidas y no varían, aun cuando dicha sustancia pura se encuentre formando parte de una mezcla Por ejemplo, el agua está formada por dos átomos de hidrógeno y un átomo de oxígeno. Si bien tiene átomos diferentes, el agua pura tiene siempre esta misma estructura y los mismos átomos.
Algunas de estas propiedades son:
• El color • El sabor • El olor • La densidad • La temperatura de (fusión y ebullición) • La solubilidad • La conductividad térmica y eléctrica.
Es característico de una sustancia pura que la temperatura a la cual sufre un cambio de estado (fusión, ebullición, etc.) permanece constante durante el cambio. Por lo tanto, el punto de congelación de 100g de agua permanece constante a 0ºC desde la congelación del primer gramo hasta la del último.
Como sustancias puras se tiene el cobre, sal, diamante, agua, azúcar de mesa, oxígeno, mercurio, ozono, entre otros. ver fig [1]
figura 1
Las sustancias puras se clasifican en:
- simples o compuestos
- Compuestas.
Ambos son homogéneos ya que mantienen sus propiedades y características.
1.1.1 Elementos Químico: Los elementos son sustancias fundamentales simples, pueden ser moleculares o atómicas, y no se descomponen en otras sustancias distintas. Ejemplo: oxígeno (O), nitrógeno (N), nitrógeno gaseoso (N2), plata (Ag), las cuales encontramos en la tabla periódica.ver fig [2]

figura 2
1.1.2 Compuestos Químico: Constan de varios elementos y por lo tanto son sustancias más complejas, Un compuesto puede separarse o descomponerse en sus elementos constituyentes, Pero todos los elementos resisten cualquier intento de fragmentación en sustancias más simples y fundamentales, están formados por un mínimo de dos elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos iniciales (reacción química)
Están formados por moléculas y éstas están formadas por unión de átomos de distintos elementos. Todas las moléculas del mismo compuesto son iguales entre sí. Es importante saber que los compuestos no son mezclas, no son separables por medios físicos. Además, tienen composiciones fijas características. ver fig [3]
figura 3
Un compuesto se representa a menudo mediante una abreviatura química compuesta de los símbolos de sus elementos. Como por ejemplo: El NaCl representa el cloruro de sodio, y el H2O representa el agua, dióxido de carbono (CO2). ver fig [4]
figura 4
1.2 Mezclas (Sustancias no puras)
Es la combinación de dos o más sustancias puras de tal forma que no ocurre una reacción química, cada sustancia mantiene su identidad y propiedades. Si después de mezclar algunas sustancias, no se pueden separar por medios físicos, se entiende que ha ocurrido una reacción química y las sustancias han perdido su identidad.ver fig [5]
figura 5
Una mezcla puede ser separada en sus componentes (sustancias) simplemente por métodos físicos. Estas pueden ser clasificadas en:
- Homogéneas.
- Heterogéneas.
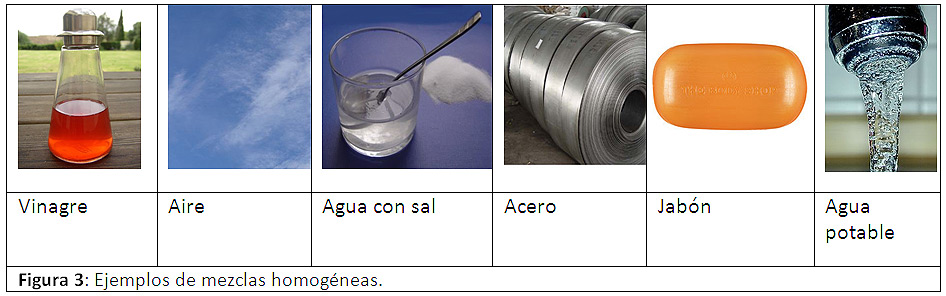
1.2.1 Mezclas Homogéneas: Son mezclas cuyos componentes se encuentran distribuidos de manera uniforme o en una fase y no se pueden distinguir a simple vista sus componentes y se denominan comúnmente soluciones, estas están formadas por un soluto ( que esta en menor proporción) y un solvente ( que esta en mayor proporción), Entre las soluciones están el agua salada, gasolina, vinagre, vodka y el aire entre otros. Una solución puede ser sólida, líquida o gaseosa, y sus componentes pueden ser elementos o compuestos. ver fig [6]
figura 6
La mezclas homogéneas se pueden separar por medio de:
- Cristalización
- Destilación Simple
- Evaporación
1.2.1.1 Separación de mezclas homogéneas
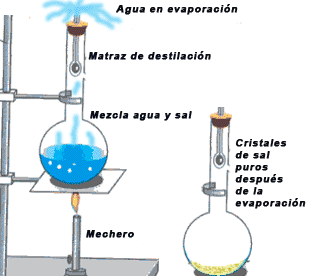
- Cristalización: La cristalización es un proceso por el cual ciertas sustancias adoptan la forma cristalina; y se utiliza en las mezclas homogéneas conformadas por un sólido (soluto) disuelto en agua (solvente) para separar la sustancia sólida, eliminando la líquida que no interesa recuperar, por evaporación, usándose frecuentemente en la purificación de sólidos. Se utiliza para ello un cristalizador, que es un recipiente de poca altura, de vidrio y de amplia boca, donde se coloca la mezcla y se procede a calentarla. Al evaporarse el líquido, por el aumento de la energía cinética de sus moléculas, el sólido precipita (cae) y queda en el cristalizador, con forma cristalina, o sea, constituyéndose un sólido homogéneo, de moléculas estáticas, delimitado por caras planas, como ocurre para producir sal o azúcar.ver fig [7]
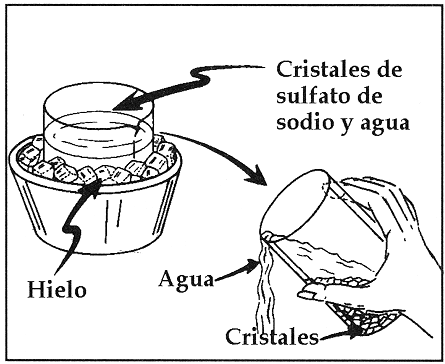
figura 7
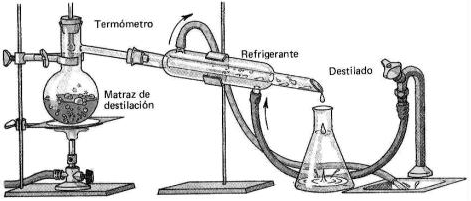
- Destilación: Esta técnica se emplea para separar líquidos de una solución en función de sus diferentes puntos de ebullición. Es el caso, por ejemplo, de una solución de dos componentes, uno de los cuáles es volátil (es decir, pasa fácilmente al estado gaseoso). Cuando se hace hervir la disolución contenida en el matraz, el disolvente volátil, que tiene un punto de ebullición menor, se evapora y deja un residuo de soluto no volátil. Para recoger el disolvente así evaporado se hace pasar por un condensador por el que circula agua fría. Ahí se condensa el vapor, que cae en un vaso o en un Erlenmeyer. ver figura [8]
figura 8
- Evaporación: Consiste en calentar la mezcla hasta el punto de ebullición de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este método se emplea si no tenemos interés en utilizar el componente evaporado. Los otros componentes quedan en el envase. Un ejemplo de esto se encuentra en las Salinas. Allí se llenan enormes embalses con agua de mar, y los dejan por meses, hasta que se evapora el agua, quedando así un material sólido que contiene numerosas sales tales como cloruro de sólido, de potasio, etc. ver fig [9]
figura 9
1.2.2 Mezclas Heterogéneas: Son aquellas cuyo aspecto diferencia una parte de otra, están formadas por dos o más componentes que se observan a simple vista y contiene cantidades diferentes de los componentes, la mezcla heterogénea puede separarse fácilmente. Pueden ser mezclas gruesas en las cuales el tamaño de las partículas es apreciable. Y emulsiones en donde las partículas se depositan con el tiempo.
Por ejemplo, mezclas de arena y sal, arena y agua, gasolina y agua, las burbujas de aire y agua, y polvo y aire.Se pueden separar por medio de:
- Filtración
- Decantación
- Separación Magnética
- Tamización
- Levigación
- Sedimentación
- Flotación
1.2.2.1 Separación de mezclas heterogéneas
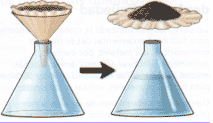
- Filtración: Este procedimiento se emplea para separar un líquido de un sólido insoluble. Las aplicaciones de los procesos de filtración son muy extensas, encontrándose en muchos ámbitos de la actividad humana, tanto en la vida doméstica como de la industria general, donde son particularmente importantes aquellos procesos industriales que requieren de las técnicas químicas
Ejemplo: A través de materiales porosos como el papel filtro, algodón o arena se puede separar un sólido que se encuentra suspendido en un líquido. Estos materiales permiten solamente el paso del líquido reteniendo el sólido.ver fig [10]
figura 10
- Decantación:Esta técnica se emplea para separar 2 fluidos no miscibles entre sí. Ejemplo: Agua y aceite. La decantación se basa en la diferencia de densidad entre los dos componentes, que hace que dejados en reposo, ambos se separen hasta situarse el más denso en la parte inferior del envase que los contiene. De esta forma, podemos vaciar el contenido por arriba (si queremos tomar el componente menos denso) o por abajo (si queremos tomar el más denso).
En la separación de dos líquidos no miscibles, como el agua y el aceite, se utiliza un embudo de decantación que consiste en un recipiente transparente provisto de una llave en su parte inferior. Al abrir la llave, pasa primero el líquido de mayor densidad y cuando éste se ha agotado se impide el paso del otro líquido cerrando la llave. La superficie de separación entre ambos líquidos se observa en el tubo estrecho de goteo ver fig [11]
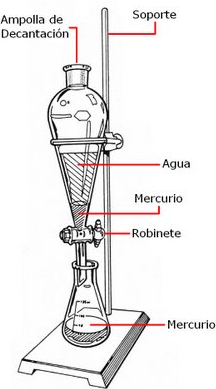
figura 11
- Separación magnética: Esta técnica sirve para separar sustancias magnéticas de otras que no lo son. Al aproximar a la mezcla el imán, éste atrae a las limaduras de hierro, que se separan así del resto de la mezcla.ver fig [12]
figura 12
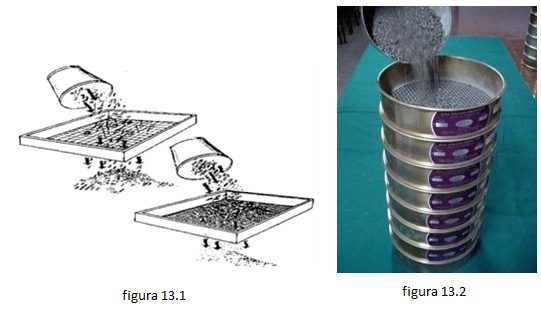
- Tamización: Es uno de los métodos de separación de mezclas, el cual consiste que mediante un tamiz , zarandas o cernidores (redes de mallas mas o menos gruesas o finas) se separan partículas sólidas según su tamaño. El tamizado básicamente es coger un tamiz que deje pasar el polvo mas fino y retenga el mas grueso. Por ejemplo en los molinos es utiliza este proceso para separar la harina del (salvado).ver fig [13.1] y [13.2]
 Levigación: Es un método se separación físico basado en las densidades de la mezcla. Consiste en pulverizar la mezcla solida y tratarla luego con disolventes apropiados, se utiliza disolviendo las sustancias en agua, las partículas mas finas quedan en suspensión, mientras que las mas pesadas quedan en el fondo. Este método es muy empleado en la minería especialmente para la separación de metales preciosos ver fig [14]
Levigación: Es un método se separación físico basado en las densidades de la mezcla. Consiste en pulverizar la mezcla solida y tratarla luego con disolventes apropiados, se utiliza disolviendo las sustancias en agua, las partículas mas finas quedan en suspensión, mientras que las mas pesadas quedan en el fondo. Este método es muy empleado en la minería especialmente para la separación de metales preciosos ver fig [14]
figura 14
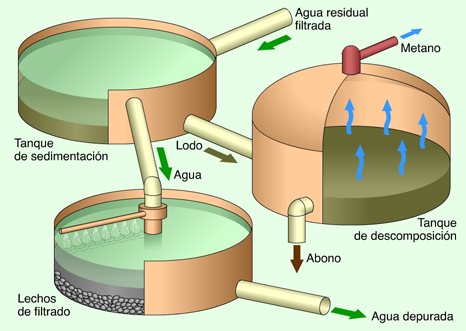
- Sedimentación: es la acumulación por deposición de todos aquellos materiales alterados y transportados previamente. Un tipo común de sedimentación ocurre cuando el material sólido, transportado por una corriente de agua, se deposita en el fondo de un río, embalse, canal artificial, o dispositivo construido especialmente para tal fin. La sedimentación depende de la corriente de agua, dependiendo de su caudal, de su velocidad y forma de la sección permite que las partículas se sedimenten o no, a una menor velocidad las partículas se sedimentaran mejor ya que la energía del medio de transporte disminuye.ver fig [15]
figura 15
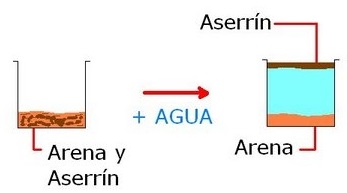
- Flotación: La flotación es en realidad una forma de decantación. Se utiliza para separar un sólido con menos densidad que el líquido en que está suspendido.Por ejemplo, en una mezcla de arena y aserrín agregamos agua . La flotación permite una separación más o menos manual de la mezcla. ver fig [16]
figura 16
1.3 ENLACES QUÍMICOS.
Para tener una mejor visión y conceptualización de la tabla periódica y los enlaces químicos, es importante conocer conceptos básicos como son por ejemplo las definiciones de qué es un átomo, una molécula, un elemento químico, una sustancia pura, una mezcla, un enlace químico, un metal, un no metal o metaloide, etc.
A continuación se explica dichos conceptos básicos requeridos para el estudio de los enlaces químicos.
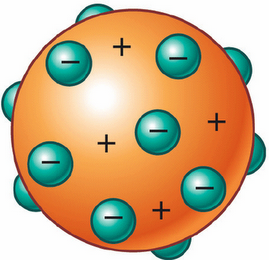
1.3.1 Átomo:El átomo de un elemento es la cantidad más pequeña de un cuerpo, que puede contribuir a la formación de una molécula. Es considerado el componente básico de toda la materia, poseen un núcleo, protones y neutrones rodeado por electrones.
Los átomos de diferentes elementos tienen diferente número de protones, el átomo más simple es el hidrógeno, qué está compuesto por un electrón y un protón. ver fig [17]
figura 17
el siguiente vídeo da una explicación detallada sobre el átomo ver el siguiente linck http://www.youtube.com/watch?v=0WnjSm-Mg1Q&feature=related
1.3.2 Molécula: Está formado por grupos de átomos unidos que forman conjuntos llamados moléculas, los átomos que se encuentran en esta se mantienen unidos debido a que comparten o intercambian electrones.
Las moléculas están hechas de átomos de uno o más elementos, algunas moléculas están hechas de un solo tipo de átomo, por ejemplo dos átomos de oxigeno se unen para formar una molécula de O2, o un átomo de nitrógeno se une con tres átomos de hidrogeno y forman una molécula llamada NH3. ver fig [18]
figura 18
1.3.3 Especie química: Las especies o individuos químicos son sustancias cuya composición no sufre alteración por medio de los cambios de estado, el agua por ejemplo, puede solidificarse o evaporarse, pero conservará siempre la misma composición química. por lo tanto, el agua es una sustancia homogénea y una especie química. ver fig [19]
Figura 19
1.3.4 Elementos químicos: Es un concepto destacado dentro de la química justamente, que se usa para designar a aquella materia que se encuentra conformada por átomos que presenta igual clase. compuesto por un número de protones en su núcleo que lo hace pertenecer a una categoría única clasificada con el «número atómico».
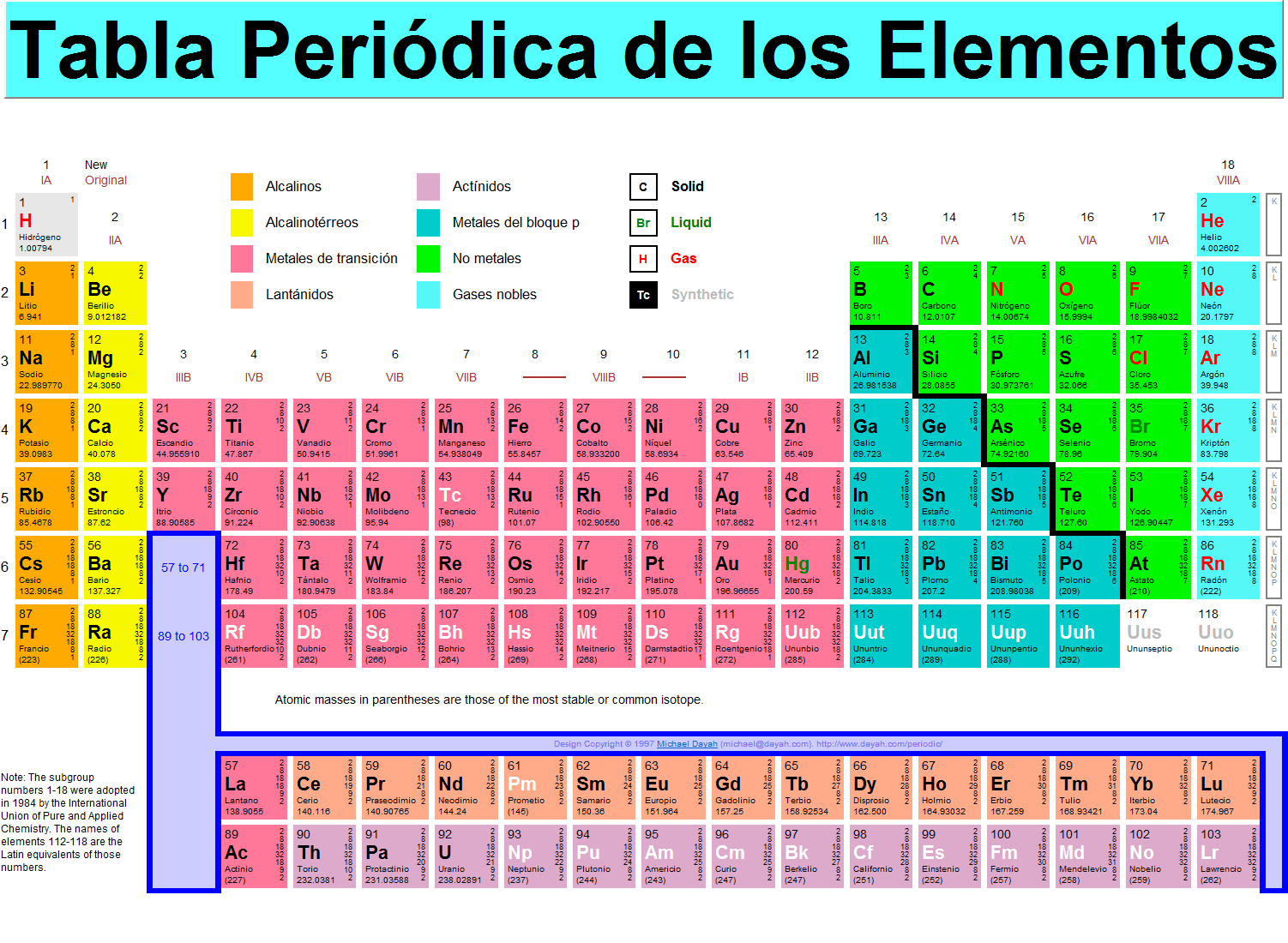
Cabe destacarse que los elementos químicos se encuentran reunidos en lo que se conoce como tabla periódica de los elementos y cada uno de ellos aparece en una posición dada en relación al número de protones presentes en su núcleo. La misión excluyente de esta es la de organizar, clasificar y distribuir los diferentes elementos químicos existentes en función de sus características y asimismo de las propiedades que ostentan. ver fig [20]
figura 20
1.3.5 Clasificación de los elementos químicos: A medida que se fueron descubriendo los elementos químicos, se observaron propiedades semejantes entre algunos de ellos, por lo que se les clasifico en dos grandes grupos: metales y no metales (o metaloides).
El sistema periódico de los elementos o mejor dicho el sistema de periodos de los elementos de mendeleiev consiste en la ordenación de éstos en varias filas horizontales y columnas verticales según el orden creciente de sus masas atómicas. Esta clasificación permitió que su autor concibiera la existencia en la naturaleza de algunos elementos hasta entonces desconocidos, así como sus principales propiedades químicas y físicas.
1.3.6 Propiedades físicas y químicas de los elementos:
1.3.6.1 Símbolo: son los distintos signos abreviados que se utilizan para identificar los elementos y compuestos químicos en lugar de sus nombres completos. La mayoría de los símbolos químicos se derivan de las letras del nombre del elemento, principalmente en latín, pero a veces en inglés, alemán, francés o ruso. La primera letra del símbolo se escribe con mayúscula, y la segunda (si la hay) con minúscula. Este conjunto de símbolos que denomina a los elementos químicos es universal. Los símbolos de los elementos pueden ser utilizados como abreviaciones para nombrar al elemento, pero también se utilizan en fórmulas y ecuaciones para indicar una cantidad relativa fija del mismo. por ejemplo el símbolo del hierro es Fe que proviene de su nombre en latín Ferrum. ver fig [21] 
figura 21
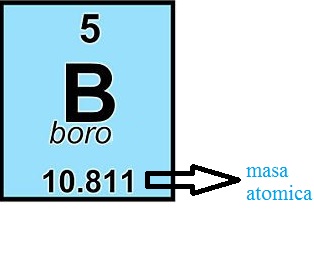
1.3.6.2 Masa atómica:Se denomina como masa atómica a la masa que presenta un átomo en reposo. En tanto, un átomo es aquella partícula más pequeña correspondiente a un elemento químico y que como tal conserva las propiedades de éste. Entonces, es correcto que se considere como masa atómica a la masa total de protones y de neutrones en un átomo único que se halla en estado de reposo.
Cabe destacar que en el Sistema Internacional de Unidades a la misma unidad se la expresa como unidad de masa atómica unificada o Dalton, cuyo símbolo es la [u] o [Da], respectivamente. ver fig [22].
figura 22
1.3.6.3 Número atómico: Es el número total de protones en el núcleo de un átomo Este número diferencia a un elemento de los demás, es también igual a la cantidad de electrones de un átomo neutro del elemento. Por ejemplo el Escandio (Sc) tiene número atómico 21, Esto quiere decir que el actinio tiene 21 protones en su núcleo. ver fig[23]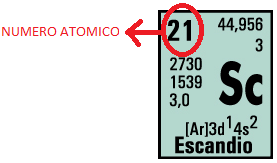 figura 23
figura 23
1.3.6.4 Número de neutrones (isotopos): El número de neutrones de un átomo es igual a la masa atómica del átomo redondeada al número entero más próximo (número másico) menos el número de protones. Esto se debe a que protones y neutrones tienen una masa atómica aproximada de 1 u.m.a (unidad de masa atomica), puesto que los elementos tienen más de un isotopo.
El número de neutrones que está plasmado en la tabla periódica se refiere al isótopo más abundante del elemento.
Ejemplo: El boro (B) tiene una masa atómica de 10.81 [g/mol] y número atómico de 5. Al redondear 10.81 [g/mol] al entero más próximo sale 11. Restando de este número 11 el número de protones (o número atómico) se obtiene 6, que indica que el isótopo más abundante del boro tiene 6 neutrones.
1.3.6.5 Estructura o configuración electrónica: Corresponde a la configuración o estructura electrónica del estado fundamental: configuración más estable y más probable.
En la tabla entre corchetes se indica la estructura del gas noble anterior al elemento que corresponde a su estructura electrónica interna y, a continuación, los electrones más externos que lo diferencian de dicho gas noble. En algunos casos se presentan anomalías.
La tabla I contiene las estructuras electrónicas por subniveles de todos los elementos hasta el 118. Además, existe una tabla para ver la relación entre llenado de los orbitales y situación en la tabla.
1.3.6.6 Electrones en los niveles de energía: Se da el número total de electrones en las distintas capas, (K,L,M,N,P,O,Q), o niveles energéticos (1,2,3,4,5,6,7) del átomo en estado fundamental.
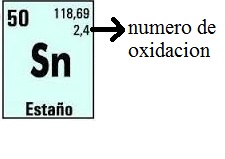
1.3.6.7 Número de oxidación: e denomina número de oxidación a la carga que se le asigna a un átomo cuando los electrones de enlace se distribuyen según ciertas reglas un tanto arbitrarias.
Las reglas son:
- Los electrones compartidos por átomos de idéntica electronegatividad se distribuyen en forma equitativa entre ellos.
- Los electrones compartidos por átomos de diferente electronegatividad se le asignan al más electronegativo.
Luego de esta distribución se compara el número de electrones con que ha quedado cada átomo con el número que posee el átomo neutro, y ése es el número de oxidación. Éste se escribe, en general, en la parte superior del símbolo atómico y lleva el signo escrito. ver fig [24]
figura 24
1.3.6.8 Electronegatividad: Es la tendencia que tiene un átomo de atraer hacia sí los electrones de su enlace con otro átomo. La diferencia de electronegatividad de entre los átomos que se unen, puede servir para establecer el tipo de enlace entre ellos.
La electronegatividad está relacionada con la afinidad electrónica y la energía de ionización del elemento, de forma a que si el elemento tiene altos valores de ambas, tiene entonces alta electronegatividad y es no metal.
1.3.6.9 Energía o potencial de ionización: La primera energía de ionización es la energía necesaria para arrancar un electrón a un átomo en estado gaseoso y transformarlo en un ion mono positivo. Valores altos indican carácter no metálico del elemento.
Los factores de que depende el potencial de ionización son:
1. La distancia al núcleo del electrón que se pierde 2. La carga del núcleo 3. El efecto pantalla de los electrones subyacentes 4. La proximidad de la estructura externa del átomo a las de los gases nobles.
1.3.6.10 Afinidad electrónica o electroafinidad: Es la energía que suministrada cuando un átomo gaseoso en su estado fundamental capta un electrón y se transforma en un ion negativo. Es una magnitud difícil de medir y en muchos casos no se conoce el valor exacto. Los valores positivos indican que cuando el átomo gaseoso gana un electrón, se desprende energía. Los valores negativos quieren decir que hay que suministrar energía para que el átomo gaseoso gane el electrón.
Valores altos indican carácter no metálico del elemento.
1.3.6.11 Radio atómico: Es la mitad de la distancia entre los centros de dos átomos contiguos del elemento. En el caso de los metales se utiliza la distancia entre los centros de dos átomos en una muestra sólida. En el caso de los no metales se utiliza la distancia entre los centros de dos átomos unidos por enlace químico y se denomina también como radio covalente.
El radio atómico aumenta en un grupo y disminuye en un periodo al aumentar el número atómico.
1.3.6.12 Número de valencia: Es una medida de la cantidad de enlaces químicos formados por los átomos de un elemento.
1.3.7 Clasificación: Como anteriormente lo mencionamos los elementos se clasifican en gases nobles, metales, no metales, metaloides o metales de transición.
Gases nobles. Son elementos químicos inertes, es decir, no reaccionan frente a otros elementos, pues en su última órbita contienen el máximo de electrones posibles para ese nivel de energía (ocho en total). El argón (Ar), por ejemplo, es un gas noble ampliamente utilizado en el interior de las lámparas incandescentes y fluorescentes. El neón es también otro gas noble o inerte, muy utilizado en textos y ornamentos lumínicos de anuncios y vallas publicitarias.
Metales. Son elementos químicos que generalmente contienen entre uno y tres electrones en la última órbita, que pueden ceder con facilidad, lo que los convierte en conductores del calor y la electricidad. Los metales, en líneas generales, son maleables y dúctiles, con un brillo característico, cuya mayor o menor intensidad depende del movimiento de los electrones que componen sus moléculas. El oro y la plata, por ejemplo, poseen mucho brillo y debido a sus características físicas constituyen magníficos conductores de la electricidad, aunque por su alto precio en el mercado se prefiere emplear, como sustitutos, el cobre y el aluminio, metales más baratos e igualmente buenos conductores. No metales. Poseen, generalmente, entre cinco y siete electrones en su última órbita. Debido a esa propiedad, en lugar de ceder electrones su tendencia es ganarlos para poder completar ocho en su última órbita. Los no metales son malos conductores del calor y la electricidad, no poseen brillo, no son maleables ni dúctiles y, en estado sólido, son frágiles. Metaloides. Son elementos que poseen, generalmente, cuatro electrones en su última órbita, por lo que poseen propiedades intermedias entre los metales y los no metales. Esos elementos conducen la electricidad solamente en un sentido, no permitiendo hacerlo en sentido contrario como ocurre en los metales. El silicio (Si), por ejemplo, es un metaloide ampliamente utilizado en la fabricación de elementos semiconductores para la industria electrónica, como rectificadores diodos, transistores, circuitos integrados, microprocesadores, etc. Un 75% de los elementos químicos existentes en la naturaleza son metales y el resto no metales y metaloides.
A las columnas verticales en la tabla periódica se les conoce como grupos, todos los elementos que conforman un grupo deben tener el mismo número de valencia, debido a esto las características y propiedades entre estos elementos son similares.
Los grupos en la tabla periódica son:
• Grupo 1: (IA) metales alcalinos.
• Grupo 2: (IIA) metales alcalinotérreos.
• Grupo 3: (IIIB) familia del escandio.
• Grupo 4: (IVB) familia del titanio.
• Grupo 5: (VB) familia del vanadio.
• Grupo 6: (VIB) familia del cromo.
• Grupo 7: (VIIB) familia del manganeso.
• Grupo 8: (VIIIB) familia del hierro.
• Grupo 9: (VIIIB) familia del cobalto.
• Grupo 10: (VIIIB) familia del níquel.
• Grupo 11: (IB) familia del cobre.
• Grupo 12: (IIB) familia del zinc.
• Grupo 13: (IIIA) los térreos.
• Grupo 14: (IVA) los carbonoideos.
• Grupo 15: (VA) los nitrogenoideos.
• Grupo 16: (VIA) los calcógenos a aflígenos.
• Grupo 17: (VIIA) los alógenos.
• Grupo 18: (VIIIA) los gases nobles.
Las filas horizontales en la tabla periódica se llaman periodos, todos los elementos que conforman un grupo deben tener la misma masa, aunque propiedades diferentes. Todos los elementos de un periodo tienen el mismo número de orbitales, ósea que están clasificados en la tabla según su configuración electrónica.
El primer periodo de la tabla tiene solo dos elementos Hidrógeno y helio, es decir que estos dos solo tienen un orbital.
1.3.8 Enlaces químicos: Un enlace químico es un proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos.
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las sustancias son los denominado enlaces químicos.
Los átomos se unen ya que al estar unidos adquieren una situación más estable que cuando estaban separados.
Está situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a 8, estructura que coincide con la de los gases nobles. Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción de helio tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable, y a ella se debe su poca reactividad.
Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos.
1.3.9 Distintos tipos de enlaces: Las propiedades de las sustancias dependen en gran medida de la naturaleza de los enlaces que unen sus átomos.
Existen tres tipos principales de enlaces químicos: Enlace iónico, enlace covalente, y enlace metálico.
Estos enlaces, al condicionar las propiedades de las sustancias que los presentan, permiten clasificarlas en: Iónicas, covalentes, y metálicas o metales.
1.3.9.1 Enlace iónico: Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica, periodos 1,2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha de la tabla periódica, especialmente los periodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico estas fuerzas eléctricas son las llamadas «enlaces iónicos».
Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio. En la siguiente simulación interactiva están representados los átomos de sodio y cloro con solo sus capas externas de electrones.
• Hacer click en el enlace y observar la ilustración didáctica •http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/enlaces/ionico.htm
1.3.9.2 Enlace covalente: Los enlaces covalente son las fuerzas que mantienen entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia), y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por lo tanto los átomos no metálicos no pueden ceder electrones entre sí.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartidos es común a los dos átomos, uno procedente de cada átomo. Ejemplo: El gas cloro está formado por moléculas de Cl2, en las que dos átomos de cloro se encuentran unidos por un enlace covalente.
•Hacer click en el enlace y observar la ilustración didáctica:
1.3.9.3 Enlace metálico: Para explicar las propiedades y características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad), es necesario conocer que los átomos de los metales tienen pocos electrones en su última capa, por lo general 1,2 o 3. Estos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos.
Los iones positivos se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red.
De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
- Hacer click en el link, y observar la ilustración didáctica
- http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/enlaces/metalico.htm
1.3.10 Conductividad. Es la propiedad de los átomos de los metales que permite a los electrones que giran en su última órbita o banda de conducción desplazarse por su estructura molecular conduciendo calor o electricidad. De acuerdo con la mayor o menor conductividad que tenga un cuerpo, se clasifican en tres grupos:
- Conductores
- Aislantes o dieléctricos
- Semiconductores
Conductores. Todos los metales conducen, en mayor o menor medida, la electricidad y el calor, pues sus átomos tienden a ceder con facilidad los electrones que giran en su última órbita. El oro (Au), la plata (Ag), el cobre (Cu), el aluminio (Al), el estaño (Sn) y el platino (Pt) son buenos conductores, mientras que el hierro (Fe) y el plomo (Pb), por ejemplo, lo son en menor medida.
Aislantes o dieléctricos. Son materiales en los que los electrones que giran en la última órbita de sus moléculas se encuentran fuertemente atraídos por el núcleo. Eso impide que se puedan desplazar libremente a través de la estructura molecular a la que pertenecen, por lo cual no conducen ni calor, ni electricidad. Entre los buenos materiales aislantes se encuentran la mica, el teflón, la porcelana, los plásticos, etc. El aire se considera también un buen aislante del calor y la electricidad.
Semiconductores. Como su nombre indica, estos materiales no son exactamente buenos conductores de la electricidad, pero cuando se les excita sus electrones pueden pasar a la banda de conducción y facilitar el flujo electrónico, aunque siempre en un solo sentido. De ahí su nombre de «semiconductores». Entre los elementos o materiales semiconductores más empleados por la industria para fabricar dispositivos electrónicos como diodos, transistores, circuitos integrados y microprocesadores se encuentran el silicio (Si), el germanio (Ge) y el arseniuro de galio (GaAs).
1.4 MATERIALES DE INGENIERÍA.
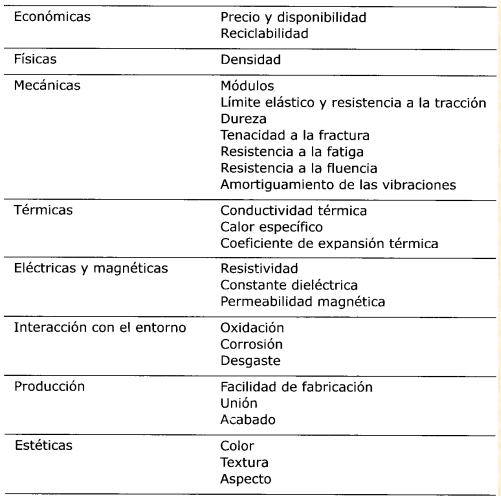
Se dice que existen mas de 50 000 materiales disponibles para el ingeniero. En el diseño de una estructura o dispositivo, ¿como elegirá el ingeniero entre un menú tan amplio el material mas adecuado?.
Teniendo en cuenta los siguientes parámetros:
Ya con esto podemos pasar a elegir algunos de los materiales de ingeniería que se dividen en 5 clases:
1.4.1 Metales: generalmente se encuentran en dos grupos: Los ferrosos: Aceros, Fundiciones de hierro, Aceros inoxidables.
Los no ferrosos: Aleaciones de cobre, aleaciones de aluminio, aleaciones preciosas, aleaciones de níquel, etc.
1.4.2 Polímeros: La materia está formada por moléculas que pueden ser de tamaño normal o moléculas gigantes llamadas polímeros. Los polímeros se producen por la unión de cientos de miles de moléculas pequeñas denominadas monómeros que constituyen enormes cadenas de las formas más diversas. Algunas parecen fideos, otras tienen ramificaciones. Algunas más se asemejan a las escaleras de mano y otras son como redes tridimensionales.
1.4.3 Cerámicos: son materiales inorgánicos compuestos por elementos metálicos y no metálicos vinculados químicamente. Pueden ser cristalinos, no cristalinos o una mixtura de ambos.
Poseen una alta dureza y resistencia al calentamiento, pero tienden a la fractura frágil. Se caracterizan principalmente por su bajo peso, alta rigidez y baja tenacidad, alta resistencia al calor y al desgaste, poca fricción y buenas propiedades aislantes.
Los materiales cerámicos son baratos, pero su procesado hasta producto terminado es normalmente lento y laborioso. Además, la mayoría de estos materiales se daña fácilmente por impacto a causa de su baja o nula ductilidad.
1.4.4 Materiales compuestos: Los materiales compuestos son aquellos que están formados por combinaciones de metales, cerámicos y polímeros.
1.4.5 Materiales de origen biológico: Se obtienen a partir de vegetales, son productos renovables y pueden mantenerse, siempre y cuando no se llegue a la sobre explotación Los más conocidos son:
• El Papel. Se compone de láminas de fibras de celulosa. Es un material poco denso y blando; se utiliza para elaborar libros, diarios, libretas, envases y envoltorios. se recupera para su reciclaje una proporción cada vez mayor de papel.
• La madera. Compuesta por celulosa y lignina, se obtiene de los troncos de los árboles. Sus propiedades dependen de la especie que la proporciona. se trata de un material ligero y bastante resistente, que se emplea en la fabricación de muebles, puertas y utensilios ligeros. se utiliza también para construir revestimientos para paredes y suelos. Se trata de un recurso en principio renovable.
BIBLIOGRAFIA
[1]http://quimicaisfd95.wikispaces.com/Tabla+Peri%C3%B3dica QUIMICA, J.B. RUSSELL/ A. LARENA
[2] http://www.scribd.com/doc/12823032/Sustancias-Puras-y-Mezclas
[3] QUIMICA I, INTRODUCCIÓN AL ESTUDIO DE LA MATERIA, ANA B. PICADO, MILTON ÁLVAREZ
[4] http://www.rena.edu.ve/TerceraEtapa/Quimica/ClasMateriaI.html
[5]http://www.youtube.com/watch?v=h2xg0YqJwBg&playnext=1&list=PL54FA5EA6F842C30F&index=1
[6] http://www.youtube.com/watch?v=OcGOwumfVgk
[7] http://www.youtube.com/watch?v=PqZCxXWlCDE&feature=related
[8] Set estudiantil Química y Ciencias Naturales Larousse.
[9] Química por Michell j. sienko y Robert A Plane. Profesores de química de la universidad de cornell
[10] http://utils.mucattu.com/elementos_quimicos.html
[11] http://sebastian-atomo.blogspot.com/ [12]http://www.educared.net/aprende/anavegar5/podium/images/B/1563/sustancias_puras.htm [13]http://www.educarecuador.ec/_upload/mezclas%20homogenes%20y%20heterogeneas.pdf
[15] http://www.profesorenlinea.cl/Quimica/PolimerosCeluloAlmid.htm [16http://www.monografias.com/trabajos-pdf5/materiales-ceramicos/materiales-ceramicos.shtml
[17]http://cienciaslacoma.blogspot.com/2011/11/tecnica-de-separacion-de-sustancias.
[18]http://www.fullquimica.com/2011/08/levigacion.html [19]http://es.slideshare.net/pabloadolfo/separacin-por-flotacin [20]http://cienciaybiologia.com/sedimentacion-y-estratificacion/ [21]http://www.asifunciona.com/quimica/af_atomos/af_atomos_5.htm [22]https://books.google.com.co/booksid=nrLSqjbHEl0C&printsec=frontcover&dq=propiedades+de+los+materiales&hl=es&sa=X&ei=hl1VVajJPLGBsQSy2IKoBQ&ved=0CBwQ6wEwAA#v=onepage&q&f=false
[23]http://www.icarito.cl/enciclopedia/articulo/segundo-ciclo-basico/ciencias-naturales/la-materia-y-sus-transformaciones/2012/12/62-9672-9-quinto-basico-mezclas-y-sustancias-puras.shtml
[24]http://fraymachete-fq.blogspot.com/2008_11_01_archive.html [25]http://quimicadecimo.wikispaces.com/LEVIGACION [26]https://sites.google.com/site/separaciondefases/flotacion
[27]http://funfairizpisua.blogspot.com/2010_12_01_archive.html
[28]http://www.educared.org/global/anavegar5/podium/images/B/1563/metodos_mecanicos.htm
[29]http://www.inovacaotecnologica.com.br/noticias/noticia.php?artigo=molecula-essencial-a-vida-e-encontrada-a-26-000-anos-luz-da-terra&id=010130081210
[30]http://www.pps.k12.or.us/district/depts/edmedia/videoteca/curso1/htmlb/SEC_132.HTM
[31]http://www.educarchile.cl/Portal.Base/Web/VerContenido.aspx?ID=106048
[32] http://www.definicionabc.com/ciencia/masa-atomica.php








estudiantes metalografia 1 intersemestral 13/07/2015
Andres Mauricio Gordillo Ruiz CC 1113040225
Juan Cristobal Grisales Grisales CC 1088297235
Roberth Andres Aguirre Arce CC 1116441088
Edwin Arlex Rodriguez Calle CC 1089745014
Estudiante de metalografía 1.
Andres Felipe Uribe B. anfeuribe@uto.edu.co 1088305908
José Esteban Chamorro A. jechamorro@utp.edu.co 1088311558
Walter Ortiz Cañsa wafeortiz@utp.edu.co 1116262161
Excelente